Перейти к:
Новые критерии качества свежезамороженной плазмы
https://doi.org/10.21886/2219-8075-2019-10-1-65-71
Аннотация
Цель: разработка новых критериев качества свежезамороженной плазмы. Материалы и методы: в разные сроки хранения свежезамороженной плазмы, заготовленной стандартно и от доноров, принимавших биолан, определяли показатели калликреин-кининовой системы, а именно: активность калликреина, ингибиторную активность α1 - протеиназного ингибитора, α2 -макроглобулина, общую аргинин-эстеразную активность, содержание прекалликреина. Результаты: в процессе карантинизации свежезамороженной плазмы, заготовленной стандартным способом, отмечается активация протеолитических процессов уже к 10 суткам от начала хранения СЗП, а подготовка доноров к кроводаче при помощи адаптогена биолан обеспечивает в ней лучшую сохранность компонентов калликреинкининовой системы. Выводы: анализ показателей калликреин-кининовой системы может быть использован как дополнительный критерий качества свежезамороженной плазмы перед проведением процедуры трансфузии.
Ключевые слова
Для цитирования:
Рябикина E.В., Черногубова Е.А., Шатохин Ю.В., Снежко И.В., Герасимова О.В., Кудинова Э.Е. Новые критерии качества свежезамороженной плазмы. Медицинский вестник Юга России. 2019;10(1):65-71. https://doi.org/10.21886/2219-8075-2019-10-1-65-71
For citation:
Ryabikina E.V., Chernogubova E.A., Shatokhin Yu.V., Snezhko I.V., Gerasimova O.V., Kudinova E.E. New quality criteria for fresh frozen plasma. Medical Herald of the South of Russia. 2019;10(1):65-71. (In Russ.) https://doi.org/10.21886/2219-8075-2019-10-1-65-71
Введение
Прогресс современной хирургии, травматологии, реаниматологии во многом определяется совершенствованием компонентной гемотрансфузионной терапии [1][2]. За последние несколько десятилетий клиническая практика переливания крови значительно изменилась. Потенциальный риск гемотрансмиссивных заболеваний привел к необходимости контроля производства безопасной и высококачественной крови, охватывающего все аспекты - от сбора и переработки до хранения крови. Строгий выбор доноров, идентификация патогенов, которые могут передаваться через кровь, и развитие технологий, которые могут повысить качество крови, привели к существенному снижению потенциальных рисков и осложнений, связанных с переливанием крови [3].
Плазма — важнейший компонент донорской крови. Приоритетной задачей трансфузиологии является сохранение уникальных свойств свежезамороженной плазмы (СЗП), так как гемотрансфузии несут определенную опасность развития осложнений, связанных с модификацией отдельных биологически активных систем крови в процессе ее хранения. Современные технологии заготовки донорской крови, основанные на целенаправленном получении отдельных компонентов крови (аферезе), молекулярном тестировании гемотрансмиссивных заболеваний, лейкоредукции, инактивации патогенов, карантинизации плазмы направлены на обеспечение безопасности и сохранение биологических свойств донорской плазмы [4]. Нарушение процесса хранения и транспортировки цельной донорской крови являются основными причинами снижения функциональных свойств СЗП. Основные требования к обеспечению безопасности по стерильным условиям, проведению карантинизации, контролю гемотрансмиссивных инфекций в РФ изложены в Постановлении Правительства РФ от 26.01.2010 г. № 29 «Об утверждении Технического регламента о требованиях безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых в трансфузионно-инфузионной терапии».
Одним из определяющих критериев качества заготавливаемых гемокомпонентов является здоровье донора. Однако врачу-трансфузиологу при первичном осмотре сложно объективно оценить соматический статус человека. Зачастую единственным лабораторным критерием допуска донора к кроводаче является содержание гемоглобина.
Свежезамороженная плазма является источником факторов, нормализующих процессы свёртывания и антипротеазную активность крови. Именно эти свойства плазмы используются для лечения многих заболеваний, сопровождающихся патологическими изменениями системы гемостаза [5].
Требования к показателям биологической полноценности, функциональной активности и лечебной эффективности свежезамороженной плазмы не отражают всего спектра уникальных характеристик плазмы как корректора плазменно-коагуляционного гемостаза. При этом не определено, когда контролировать плазму — до, после замораживания или в процессе её хранения. Анализ морфологических, биохимических и других процессов, происходящих при длительном хранении СЗП при низких температурных режимах, стал особенно актуальным в связи внедрением в практику работы учреждений, заготавливающих донорскую кровь, требований приказа МЗ РФ от 07.05.2003 № 193 (в ред. приказов Минздравсоцразвития РФ от 21.02.2005 № 147, от 19.03 2010 №170) «О внедрении в практику работы службы крови в Российской Федерации метода карантинизации свежезамороженной плазмы».
Плазменно-коагуляционное звено системы гемостаза обеспечивает свёртывание крови. В каскаде свёртывания продукт каждой ферментативной реакции является катализатором для следующей реакции, профермент превращается в соответствующий фермент, который катализирует превращение следующего профермента в сериновую протеазу. Факторы XII, XI, IX, X, II, VII и прекалликреин активируются до сериновых протеаз, факторы V, VIII и высокомолекулярный кининоген являются кофакторами этих реакций. Усиление свертывания осуществляется через петли положительных обратных связей, охватывающих каскад и через образование кофакторных комплексов, что увеличивает активность соответствующих ферментов в 105-107 раз [6][7]. Калликреин-кининовая система (ККС) является эндогенным мультибелковым каскадом, активация которого приводит к срабатыванию внутреннего пути коагуляции и ферментативному гидролизу кининогенов (Фактор Фитцджеральда) с последующим высвобождением брадикинина. Калликреин-кининовая система играет центральную роль в регуляции активности каскадных протеолитических систем плазмы крови: кининогенеза, гемокоагуляции, фибринолиза, комплемента и ренин-ангиотензиновой системы. Полифункциональность ККС обусловливает ее участие в процессах адаптации и защиты организма как в номе, так и при патологических состояниях разного генеза [8][9]. В связи этим перспективным представляется анализ сохранности основных компонентов ККС в СЗП в процессе ее карантинизации.
Цель исследования — разработка новых критериев качества свежезамороженной плазмы.
Материалы и методы
Исследование проведено на базе Ростовского государственного медицинского университета. Группу исследования составили 75 доноров. Доноры обследовались в соответствии с нормативными документами и были допущены к донациям. Первую группу составили 48 доноров без предварительной подготовки к кроводаче. Во второй группе (27 человек) доноры получали биолан интраназально в дозе 3 мг 3 раза в день в течение 3-х дней до донации. Плазму крови доноров хранили в герметичных полимерных контейнерах фирмы ГринКросс (Корея) с консервантом CPD (100 мл консерванта содержит: лимонную кислоту безводную — 0,327 г, цитрат натрия безводный — 2,63 г, бифосфат натрия водный — 0,222 г, декстрозу водную — 2,55 г, воду для инъекций q.s.). Контейнеры с плазмой хранили при температуре -400 С в биомедицинском холодильнике MDF-U-5411 (- 45С).
Для оптимизации подготовки доноров к кроводаче применяли «Биолан» (Регистрационное удостоверение № 001774.Р.643.06.2000). Биолан представляет собой комплекс пептидов, содержащих 7 незаменимых (гистидин, лейцин, лизин, метионин, фенилаланин, триптофан, валин) и 9 заменимых (аланин, аргинин, аспарагин, карнитин, цистеин, цистин, глутаминовая кислота, глутамин, глицин) аминокислот. Препарат обладает стабилизирующим клеточный гомеостаз действием, антирадикаль- ными и мембрано-стабилизирующими свойствами. Изучали влияние биолана на состояние ККС крови после 3-хдневного курса его приема у доноров и после 10, 20, 90 и 180 суток хранения свежезамороженной плазмы, заготовленной от доноров, принимавших биолан.
Сбалансированностью системы протеазы-ингибиторы определяется уровень протеолитических процессов в свежезамороженной плазме. В связи с этим, проанализировано состояние протеаз и ингибиторов калликреин- кининовой системы в СЗП в процессе ее карантинизации. Определяли активность калликреина и содержание прекалликреина [10], общую аргинин-эстеразную активность [11], ингибиторную активность α1-протеолитического ингибитора (α1-ПИ) и α2-макроглобулина (α2-МГ) [12] в плазме крови доноров в день донации. Последующие этапы исследования выполнялись через 10 и 20, 90 и 180 дней от начала хранения СЗП.
Статистический анализ проводили с использованием общепринятых методов вариационной статистики и стандартного пакета прикладных программ STATISTICA. Статистически достоверными считали отличия, соответствующие оценке ошибки вероятности р<0,05.
Результаты
Результаты исследования показали, что к 10-м суткам хранения свежезамороженной плазмы отмечается снижение на 8,3 % (ра<0,05) содержания прекалликреина (Фактора Флетчера), необходимого для сохранения реологических свойств крови (табл. 1).
Таблица / Table 1.
Состояние основных показателей калликреин-кининовой системы плазмы крови в разные сроки хранения СЗП, M± m
Status of the main components of the kallikrein-kinin system of blood plasma at different times of storage of the FFP, m± m
Этапы исследования Stages researches | Активность калликреина, мед/мл Activity of kallikrein, MEU/ml | Содержание прекалликреина, мед/мл Level of prekal- likrein, MEU/ml | Общая аргинин-эстеразная активность, мед/мл Total arginine- esterase activity, MEU/ml | Активность α1- протеиназного ингибитора, ИЕ/мл Activity of α1-proteinase inhibitor, IU/ml | Активность α2- макроглобулина, ИЕ/мл Activity of α2 - macroglobulin, IU/ml |
|---|---|---|---|---|---|
Доноры Donors (n= 42 ) | 11,38±0,92 | 319,69± 3,36 | 138,87± 4,85 | 27,04±1,03 | 4,30±0,22 |
Через 10 суток хранения After 10 days of storage | 15,70±0,86а | 293,18±4,28а | 125,31±4,49 | 25,33±1,24 | 3,05±0,64 |
Через 20 суток хранения After 20 days of storage | 24,38±1,04ав | 199,23±5,42ав | 63,72±2,92ав | 14,31±1,06ав | 2,57±0,14ав |
Через 90 суток хранения After 90 days of storage | 25,11±0,92ав | 189,27±5,98ав | 64,24±3,48ав | 15, 24±1,58ав | 2,60±0,26 |
Через 180 суток хранения After 180 days of storage | 25,48±1,22ав | 186,85±6,20ав | 63,60±4,36ав | 14,88±1,46ав | 2,48±0,38 |
Примечание: а — достоверность отличий изучаемых показателей от таковых у доноров (р<0,05);в — достоверность отличий изучаемых показателей через 10 суток хранения от таковых на последующих этапах хранения СЗП (р<0,05).
Note: a — the significance of the differences between the studied indicators from those of donors (p<0.05); b — the significance of the differences between the studied indicators after 10 days of storage from those at the subsequent stages of storage of FFP (p<0.05).
К 10-м суткам хранения СЗП отмечено увеличение активности калликреина на 38,0 % (ра<0,001), по сравнению с таковым у доноров. Несмотря на увеличение активности калликреина, суммарная активность трипсиноподобных протеиназ не изменилась. Необходимо отметить, что ингибиторная активность α1-ПИ и α2-МГ к 10-м суткам хранения СЗП также не изменилась.
К 20-м суткам хранения плазмы крови активность калликреина продолжает увеличиваться, превышая таковую у доноров на 114,2 % (ра<0,001). Следствием интенсификации калликреиногенеза является снижение на 37,7 % (ра<0,001), по сравнению с таковым до начала хранения содержания прекалликреина (фактора Флетчера). Необходимо отметить, что калликреин играет центральную роль в регуляции активности протеолитических систем крови, ответственных за поддержание ее нормального агрегатного состояния.
К 20-м суткам хранения плазмы крови отмечено также снижение общей аргинин-эстеразной активности плазмы на 54,1 % (ра<0,001) по сравнению с таковой при взятии крови. Отмечалось также снижение ингибиторной активности α1-протеиназного ингибитора и α2-макроглобулина на 46,9 % (р <0,001) и 40,2% (р <0,001) соответственно.
Ослабление ингибиторного потенциала крови приводит, по-видимому, к активации калликреина.
Через 90 и 180 суток хранения СЗП не отменено изменений изучаемых показателей ККС, по сравнению с таковым через 20 суток. Это позволяет сделать вывод о том, что уже на начальных этапах хранения СЗП происходят основные перестройки в системе протеазы-ингибиторы ККС.
У доноров приём биолана привел к уменьшению на 24,42 % (ра<0,001) суммарной протеолитической активности крови. Снижение протеолитического потенциала СЗП обеспечивает «сохранность» и других компонентов калликреин-кининовой системы крови в процессе карантинизации плазмы (табл. 2).
Таблица / Table 2
Влияние биолана на некоторые показатели калликреин-кининовой системы плазмы крови in vivo и в разные сроки хранения СЗП, M± m
Influence of Biolan on in blood plasma in vivo and at different times of storage of FFP, M± m
Этапы исследования Stages researches | Активность калликреина, мед/мл Activity of kallikrein, MEU/ ml | Содержание прекалликреина, мед/мл Level of prekallikrein, MEU/ ml | Общая аргинин-эстеразная активность, мед/мл Total arginineesterase activity, MEU/ml | Активность α1- протеиназного ингибитора, ИЕ/мл Activity of α1 - proteinase inhibitor, IU/ml | Активность α2- макроглобулина, ИЕ/мл Activity of α2- macroglobulin, IU/ml |
|---|---|---|---|---|---|
Доноры Donors (n= 42 ) | 11,38±0,92 | 319,69± 3,36 | 138,87±4,85 | 27,04±1,03 | 4,30±0,22 |
Доноры после приема биолана Donors after Biolan exposure (n=27) | 13,26±0,48 | 334,72±9,98 | 104,95±3,44а | 28,30±2,43 | 3,59±0,40 |
Через 10 суток хранения After 10 days of storage | 13,94±0,56 | 338.46±8,94 | 108,36±5,12а | 27,44±2,48 | 3,68±0,64 |
Через 20 суток хранения After 20 days of storage | 13,05±0,44 | 336,24±8,42 | 105,84±5,04а | 20,94±4,42 | 3,72±0,52 |
Через 90 суток хранения After 90 days of storage | 14,04±0,84 | 330,46±7,36 | 100,44±4,22а | 21,56±3,68 | 3,54±0,86 |
Через 180 суток хранения After 180 days of storage | 14,28±0,82 | 325,62±8,42 | 94,12±3,98а | 20,12±2,36ав | 3,36±0,64 |
Примечание: а — достоверность отличий изучаемы показателей от таковых у доноров, (р<0,05).; в — достоверность отличий изучаемых показателей через 10 суток хранения от таковых через 20 суток хранения, (р<0,05).
Note: a — the significance of the differences from those of donors (p<0.05).; b — the significance of the differences of the studied parameters after 10 days of storage from those after 20 days of storage, (p<0.05).
Так, через 10 суток хранения СЗП доноров, получавших биолан, не отмечено значимых изменений компонентов калликреин-кининовой системы крови. Только к 20-м суткам хранения СЗП отмечается некоторое снижение активности антипротеиназных систем плазмы крови за счёт наметившейся тенденции к уменьшению ингибиторной активности α1-протеиназного ингибитора, остальные же компоненты ККС крови не отличались от таковых до начала хранения плазмы. К 20-м суткам и на более поздних этапах хранения СЗП тенденция в изменении изучаемых показателей ККС не изменилась. Обращает на себя внимание снижение на 25,5 9% (ра<0,05), по сравнению с таковым у доноров ингибиторной активности α1-протеиназного ингибитора к 180-м суткам хранения СЗП.
Обсуждение
С целью усиления контроля за производством безопасной и высококачественной крови перед трансфузией пациенту донорская плазма подвергается процедуре карантинизации. Процесс карантинизации предполагает хранение СЗП в течение 6 месяцев при температуре ниже -30°С. Предполагается, что при карантинизации должны сохраняться уникальные свойства плазмы крови [13]. Однако сохраняется вероятность развития у реципиента серьезных осложнений, несмотря на то что СЗП проходит сложный многоэтапный анализ до и после каранти- низации. В связи этим разработка независимых методов анализа донорской плазмы и новых критериев оценки качества плазмы перед ее трансфузией пациенту является перспективной задачей трансфузиологии.
Результаты исследования показали, что к 10-м суткам хранения плазмы наблюдаются начальные фазы активации ККС. Дисбаланс компонентов ККС крови к 20-м суткам увеличивается и сохраняется на более поздних этапах исследования (через 90 и 180 суток). В связи с тем что калликреин-кининовая система относится к системам «плавающих» гуморальных регуляторов, которые определяют адаптационные возможности организма при патологических состояниях разного генеза, дисбаланс в системе протеазы-ингибиторы ККС может повлиять на эффективность переливания СЗП (рис. 1).
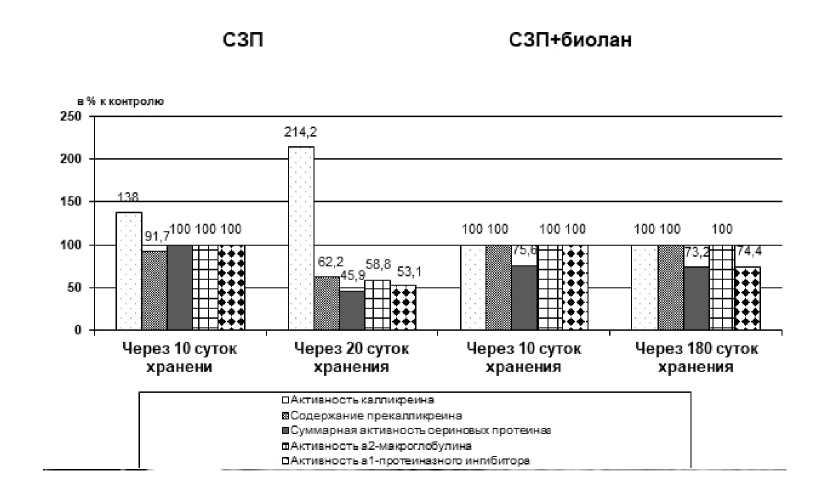
Рисунок 1. Влияние биолана на некоторые показатели калликреин-кининовой системы на разных этапах хранения СЗП
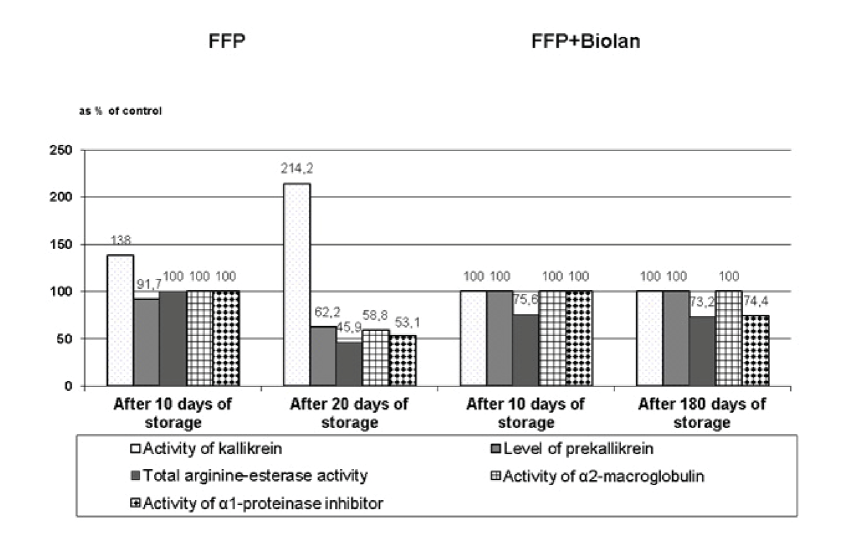
Figure 1. Influence of Biolan on certain components of the kallikrein-kinin system at different stages of storage of FFP.
Увеличение активности калликреина приводит к активации других протеолитических систем плазмы крови. На первый план в данных условиях выступает, по-видимому, превращение плазменного прекалликреина (белка-предшественника) в калликреин в так называемой «контактной системе активации» за счет появления при замораживании плазмы крови анионных «полей» [7]. Этот вывод подтверждается снижением содержания прекалликреина в СЗП через 20 суток хранения. Необходимо отметить, что «контактная система активации» рассматривается как триггерный механизм, запускающий активацию всех пяти протеолитических систем плазмы крови: калликреин-кининовую и ренин-ангиотензиновую системы, гемокоагуляцию, фибринолиз, комплемент. Активации протеолиза в процессе карантинизации плазмы крови способствует угнетение ингибиторной активности α1-ПИ и α2-МГ.
Следствием активации протелитических процессов в СЗП при ее хранении является смещение в сторону положительных значений редокс-потенциала крови, что свидетельствует об её окислении [14]. Вероятно, активация протеолиза в СЗП в процессе ее хранения увеличивает доступность белков для их окислительной модификации.
Несмотря на достижения современной медицины, сохраняется необходимость применения аллогенной донорской крови. Это требует, с одной стороны, совершенствования методов хранения СЗП, с другой разработки информативных критериев оценки качества гемокомпонентов. Необходимо отметить, что требованиями Совета Европы регламентирован контроль активаторов прекалликреина в свежезамороженной плазме, который России не предусмотрен.
Перспективным направлением подготовки доноров к кроводаче крови является предварительное введение донорам препаратов, способных влиять на состояние ключевых гомеостатических систем организма. В последнее время достигнуты значительные успехи в изучении механизмов регуляции физиологического гомеостаза, которые стали основой для разработки нового класса лекарственных препаратов, функционально и химически соответствующих естественным эндогенным биорегуляторам. К таким препаратам принадлежат адаптогены, перспективный класс биологически активных веществ, способных повышать адаптивные возможности организма в условиях стресса. Использование адаптогенов приводит к адаптивной перестройке метаболизма, повышая сопротивляемость организма к различным факторам внутренней и внешней среды. В связи с этим, с целью повышения качества переливаемых компонентов крови, у доноров необходимо проводить индивидуальную оценку адаптивно-компенсаторных возможностей организма и с учетом выявленных особенностей, проводить подготовку к кроводаче.
Анализ результатов исследования показал, что в плазме крови доноров, получавших биолан, в процессе ка- рантинизации не отмечено интенсификации протеолитических процессов, а суммарная активность сериновых протеаз снижается (рис. 1). Одним из возможных механизмов действия биолана является ингибирующее влияние на сериновые протеазы крови аминокислот, входящих в состав биолана. Таким образом, подготовка доноров к кро- водаче с применением адаптогенов позволяет обеспечить сохранность СЗП в процессе карантинизации.
Анализ компонентов калликреин-кининовой системы крови может быть использован как дополнительный независимый метод анализа донорской плазмы перед ее трансфузией пациенту.
Заключение
Результаты исследования показали, что «преадаптация» доноров перед кроводачей с применением адаптогенов позволяет минимизировать риск снижения качества свежезамороженной плазмы крови в процессе карантинизации. Под действием биолана снижается протеолитический потенциал крови, что увеличивает сохранность корректоров плазменно-коагуляционного гемостаза. Анализ показателей калликреин-кининовой системы крови может быть использован как дополнительный критерий качества свежезамороженной плазмы перед проведением процедуры трансфузии.
Список литературы
1. Рябикина Е.В., Черногубова Е.А., Женило В.М., Микашинович З.И. Оптимизация трансфузионной терапии при перитоните. // Общая реаниматология. – 2009. – Т. V. –№ 1. – С. 24-27. doi: 10.15360/1813-9779-2009-1-24.
2. Федосов М.И., Бабанин А.А., Кубышкин А.В., Биркун А.А., Глотов М.А., и др. Прогностическое значение провоспалительных цитокинов и компонентов протеиназ-ингибиторной системы сыворотки крови пациентов с критическими состояниями// Крымский журнал экспериментальной и клинической медицины. – 2016. – Т. 6. – №1. – С.27-31.
3. Green L., Allard S., Cardigan R. Modern banking, collection, compatibility testing and storage of blood and blood components //Anaesthesia. 2015, 70 (Suppl. 1), 3–9. Doi: 10.1111/ anae.12912.
4. Чечеткин А.В., Данильченко В.В., Григорьян М.Ш., Макеев А.Б., Воробей Л.Г., Солдатенков В.Е. Совершенствование технологий заготовки и обеспечения безопасности плазмы в учреждениях службы крови // Трансфузиология. – 2014. – Т. 15. – № 4. – С.14-22.
5. Глотов М.А., Биркун А.А., Рябикина Е.В., Самарин С.А., Федосов М.И. Дифференцированное назначение гемостатических средств при острой массивной кровопотере. // Тромбоз, гемостаз и реология. – 2017. – № 2 (70). – С. 13-18. Doi: 10.25555/THR.2017.2.0778.
6. Kashuba E. Bailey J., Allsup D., Cawkwell L. Th e kinin–kallikrein system: physiological roles, pathophysiology and its relationship to cancer biomarkers // Biomarkers. – 2013. – Vol. 18, (Suppl.4). – P. 279-296. Doi: 10.3109/1354750X.2013.787544.
7. Lynch J., Shariat-Madar Z. Physiological eff ects of the plasma kallikrein-kinin system: roles of the blood coagulation factor XII (Hageman Factor) // J. Clinic. Toxicol. – 2012. – Vol. 2, (Suppl.) 3. – P. 100-105. Doi: 10.4172/2161-0495.1000e105.
8. Яровая Г. А., Нешкова А.Е. Калликреин-кининовая система. прошлое и настоящее. (к 90-летию открытия системы). //Биоорганическая химия. – 2015. – Т. 41. – № 3, – С. 275–291. Doi: 10.7868/S0132342315030112.
9. Schmaier A.H. Th e contact activation and kallikrein/kinin systems: pathophysiologic and physiologic activities.// J. Th romb. Haemost. – 2016. – Vol.14, (Suppl.1). – Р. 28-39. Doi: 10.1111/ jth.13194.
10. Пасхина Т.С., Кринская А.В. Упрощенный метод определения калликреиногена и калликреина в сыворотке (плазме) крови человека в норме и при некоторых патологических состояниях // Вопросы медицинской химии. – 1974. – Т.20. – №6. – С.660-663.
11. Пасхина, Т.С., Яровая Г.А. Калликреин сыворотки крови человека. Активность фермента и хроматографический метод определения// Биохимия. – 1970. – Т.35. – №5. – С.1055- 1058.
12. Нартикова В.Ф., Пасхина Т.С. Унифицированный метод определения активности -макроглобулина в сыворотке (плазме) крови человека // Вопросы медицинской химии. – 1979. – Т.25. – №4. – С.494-502.
13. Рагимов А.А., Щербакова Г.Н. Инфузионно-трансфузионная терапия. – М.: ГЭОТАР-Медиа, 2014. – 248 с.
14. Горончаровская И.В., Капелькина М.А., Иванова К.В., Царькова Т.Г. Оценка качества свежезамороженной плазмы с помощью измерения редокс потенциала// Успехи в химии и химической технологии. – 2016. – Т. XXX. – № 3. – С.11-12.
Об авторах
E. В. РябикинаРоссия
к.м.н., ассистент кафедры гематологии и трансфузиологии с курсами клинической лабораторной диагностики, генетики и лабораторной генетики ФПК и ППС
Е. А. Черногубова
к.б.н., ведущий научный сотрудник
Ю. В. Шатохин
д.м.н., профессор кафедры гематологии и трансфузиологии с курсами клинической лабораторной диагностики, генетики и лабораторной генетики ФПК и ППС
И. В. Снежко
к.м.н., доцент кафедры гематологии и трансфузиологии с курсами клинической лабораторной диагностики, генетики и лабораторной генетики ФПК и ППС
О. В. Герасимова
ассистент кафедры гематологии и трансфузиологии с курсами клинической лабораторной диагностики, генетики и лабораторной генетики ФПК и ППС
Э. Е. Кудинова
зав. зональной лабораторией иммунологического типирования тканей
Рецензия
Для цитирования:
Рябикина E.В., Черногубова Е.А., Шатохин Ю.В., Снежко И.В., Герасимова О.В., Кудинова Э.Е. Новые критерии качества свежезамороженной плазмы. Медицинский вестник Юга России. 2019;10(1):65-71. https://doi.org/10.21886/2219-8075-2019-10-1-65-71
For citation:
Ryabikina E.V., Chernogubova E.A., Shatokhin Yu.V., Snezhko I.V., Gerasimova O.V., Kudinova E.E. New quality criteria for fresh frozen plasma. Medical Herald of the South of Russia. 2019;10(1):65-71. (In Russ.) https://doi.org/10.21886/2219-8075-2019-10-1-65-71







































