Перейти к:
Взаимосвязь полиморфизма rs622342 SLC22A1 с краткосрочными изменениями показателей метаболизма жиров и углеводов при различных вариантах терапии ранних нарушений углеводного обмена у женщин
https://doi.org/10.21886/2219-8075-2025-16-1-39-45
Аннотация
Цель: изучить взаимосвязь полиморфизма rs622342 SLC22A1 с краткосрочными изменениями показателей метаболизма жиров и углеводов при различных вариантах терапии ранних нарушений углеводного обмена. Материалы и методы: проведён анализ результатов обследования и лечения 89 пациенток с избыточной массой тела и факторами риска развития сахарного диабета 2 типа. На протяжении 3 месяцев 53 участницы исследования соблюдали диетотерапию, 36 пациенток дополнительно к диете принимали метформин. Всем пациенткам проведено генотипирование rs622342 SLC22A1. Также изначально и через 3 месяца от начала терапии были определены тощаковая глюкоза, гликированный гемоглобин, общий холестерин, липиды низкой плотности и высокой плотности, триглицериды. Статистическая обработка проведена с использованием параметрических и непараметрических критериев. Результаты: через 3 месяца от начала диетотерапии гомозиготные носительницы СС по сравнению с носительницами аллеля А rs622342 SLC22A1 показали значимое снижение уровня общего холестерина и триглицеридов. При добавлении метформина к диетотерапии данной закономерности не наблюдалось. Значимых различий в изменении уровня тощаковой гликемии, гликированного гемоглобина в группах с разной тактикой ведения пациенток не отмечалось. Выводы: среди носительниц СС rs622342 SLC22A1 наблюдается значимое снижение уровней общего холестерина, триглицеридов по сравнению с носительницами аллеля А через 3 месяца общепринятой при нарушениях углеводного обмена диетотерапии; при добавлении к схеме лечения метформина данных изменений не наблюдается.
Для цитирования:
Валеева Ф.В., Медведева М.С., Киселева Т.А., Хасанова К.Б., Набиуллина Р.М. Взаимосвязь полиморфизма rs622342 SLC22A1 с краткосрочными изменениями показателей метаболизма жиров и углеводов при различных вариантах терапии ранних нарушений углеводного обмена у женщин. Медицинский вестник Юга России. 2025;16(1):39-45. https://doi.org/10.21886/2219-8075-2025-16-1-39-45
For citation:
Valeeva F.V., Medvedeva M.S., Kiseleva T.A., Khasanova K.B., Nabiullina R.M. Association of rs622342 SLC22A1 with the short-term changes of lipid and carbohydrate metabolism indicators in different variants of early carbohydrate metabolism disorders management in women. Medical Herald of the South of Russia. 2025;16(1):39-45. (In Russ.) https://doi.org/10.21886/2219-8075-2025-16-1-39-45
Введение
Сахарный диабет (СД) является одним из четырёх приоритетных неинфекционных заболеваний, представляющих собой серьёзную медико-социальную проблему во всех странах мира [1]. По результатам эпидемиологического исследования NATION, 19,2% населения РФ имеют предшествующий СД предиабет, диагностированный по уровню HbA1C [2], однако при использовании критерия тощаковой гликемии количество пациентов с ранними нарушениями углеводного обмена (НУО) может достигать 28,1% населения России [3]. Известно, что проведение профилактических мероприятий уже на этапе предиабета позволяет обеспечить предотвращение или замедление развития СД 2 типа, а также его микро- и макрососудистых осложнений [4]. Данные мероприятия, помимо нормализации уровня гликемии, должны быть направлены на снижение массы тела, нормализацию показателей артериального давления и липидного обмена. Согласно «Алгоритмам специализированной медицинской помощи больным сахарным диабетом» 11-го пересмотра (2023 г.), при выявлении ранних НУО, помимо обучения пациента принципам диетотерапии, возможно назначение метформина [5]. Кроме сахароснижающего действия, данный препарат обладает рядом плейотропных эффектов, таких как кардиопротекция, нейро- и онкопротективное действие, а также нормализация липидного обмена за счёт подавления выработки и активности белков SREBP-1 и аполипопротеина В-48, регулирующих метаболизм жирных кислот [6]. Однако терапевтический ответ на приём метформина вариабелен, что может быть обусловлено генетическими особенностями пациента [7].
Одним из генов, способных модулировать ответ на терапию метформином, является SLC22A1. Данный ген кодирует катионный транспортер типа 1 (organic cation transporter type 1, OCT1), осуществляющий транспорт метформина из кровотока в клетки печени [8]. В настоящее время известно более 34 полиморфизмов данного гена [9], однако наибольший интерес для изучения представляет полиморфный маркер rs622342 SLC22A1.
Цель исследования — изучение взаимосвязи полиморфизма rs622342 SLC22A1 с краткосрочными изменениями показателей метаболизма жиров и углеводов при различных вариантах терапии ранних нарушений углеводного обмена.
Материалы и методы
В исследование были включены женщины с избыточной массой тела или ожирением (ИМТ≥25 кг/м2), а также наличием иных факторов риска развития нарушений углеводного обмена (семейный анамнез, СД 2 типа, нарушенная гликемия натощак или нарушенная толерантность к глюкозе в анамнезе, уровень липопротеидов высокой плотности ≤ 0,9 ммоль/л и/или уровень триглицеридов ≥ 2,82 ммоль/л в анамнезе, гестационный СД или рождение крупного плода в анамнезе, наличие сердечно-сосудистых заболеваний, синдрома поликистозных яичников). Важным условием включения в исследование было проживание на территории Республики Татарстан не менее чем в трёх поколениях, установленное путём анкетирования. Протокол исследования получил одобрение Локального Этического Комитета ФГБОУ ВО Казанский ГМУ Минздрава России (протокол заседания №10 от 18.12.2018 г.). Всем пациентам были разъяснены цели и методы исследования, на основании чего каждый пациент подписал добровольное информированное согласие на участие в исследовании. В начале исследования всем пациентам был проведён забор венозной крови для определения уровней тощаковой глюкозы, общего холестерина (ОХ), липопротеидов высокой плотности (ЛПВП), липопротеидов низкой плотности (ЛПНП), триглицеридов (ТГ) энзиматическим колориметрическим методом (набор реагентов «Ольвекс Диагностикум», г. Санкт-Петербург; биохимический анализатор Stat Fax 4500, США). Также было выполнено определение уровня гликированного гемоглобина (HbA1C) экспресс-методом (анализатор Abbott NycoCard Reader II, США). Дополнительно для выявления нарушений углеводного обмена всем пациенткам был проведён пероральный глюкозотолерантный тест (ПГТТ) со стандартной нагрузкой 75 г безводной глюкозы, растворённой в 300 мл воды. Также было проведено определение полиморфизма rs622342 SLC22A1 при помощи полимеразной цепной реакции (ПЦР) в режиме реального времени (набор реагентов «Синтол», г. Москва; амплификатор CFX96, США). Субстратом для реакции являлась ДНК, полученная из лимфоцитов цельной крови пациенток сорбентным методом (комплект реагентов «ДНК-сорб-В»; ООО «ИЛС», г. Москва). Далее пациентов рандомизировали на две терапевтические группы. Участницы первой группы придерживались общепринятого при нарушениях углеводного обмена питания, подразумевающего исключение из рациона простых углеводов и ограничение употребления сложных углеводов и жиров. Участницы второй группы, помимо соблюдения диетотерапии, принимали метформин в терапевтической дозе. Контроль за соблюдением рекомендаций производился путём очных встреч 1 раз в 2 недели с проверкой дневников питания. Через 3 месяца всем пациенткам вновь оценивались липидный спектр, уровень тощаковой глюкозы, HbA1C. Статистическая обработка данных производилась при помощи программ IBM SPSS Statistics 26.0, Microsoft Excel 2016. Для оценки соответствия распределения генотипов равновесию Харди–Вайнберга был использован критерий χ2. При изучении взаимосвязи rs622342 SLC22A1 с изменениями липидного профиля учитывалась рецессивная модель наследования, а именно сравнивались показатели групп пациенток с отсутствием и наличием аллеля А. Предварительно проводилась проверка соответствия изучаемых выборок нормальному распределению при помощи теста Шапиро-Уилка. Если распределение отличалось от нормального, то при сравнении групп применялся U-критерий Манна-Уитни. Статистические данные представлены в виде M±σ в случае нормального распределения и в виде Ме [Q25; Q75], если данные не подчинялись нормальному распределению. Результаты считались статистически значимыми при p ≤0,05.
Результаты
Всего в исследование были включены 118 женщин, однако 29 пациенток выбыли из наблюдения по причине нарушения рекомендованной терапии. В итоге были проанализированы результаты терапии 89 пациенток в возрасте от 25 до 65 лет (средний возраст — 47±14 лет) с наличием избытка массы тела или ожирения (средний ИМТ до начала исследования 33,67±5,81 кг/м2). В группу «диетотерапии» вошли 53 пациентки, метформин дополнительно к соблюдению диеты принимали 36 человек. Хотя распространённость генотипов и аллеля А rs622342 SLC22A1 в изучаемых группах была сопоставима (табл. 1), в группе «диетотерапии» распространённость генотипов и аллеля А не соответствовала закону генетического равновесия Харди-Вайнберга (χ2=4,39; p=0,04), что может быть объяснено более высокой встречаемостью аллеля риска С в выборке. В группе «диетотерапии и метформина» распространённость генотипов и аллеля А отвечала закону Харди-Вайнберга (χ2=0,57; p=0,44).
Таблица / Table 1
Распространённость генотипов, аллеля А rs622342 SLC22A1 в исследуемых группах
Prevalence of genotypes and A-allele of rs622342 SLC22A1 in the study groups
|
|
Генотип АА (%) |
Генотип АС (%) |
Генотип СС (%) |
Аллель А A-allele (%) |
|
Все пациенты |
56 |
31 |
13 |
72 |
|
Группа «диетотерапии» |
58 |
28 |
14 |
73 |
|
Группа «диетотерапии и метформина» |
52 |
36 |
12 |
21 |
Сравниваемые группы были сопоставимы по распределению НУО, а также степени выраженности избытка массы тела (табл. 2,3).
Таблица / Table 2
Распределение наличия избытка массы тела и ожирения в исследуемых группах (%)
Distribution of overweight and obesity in the study groups (%)
|
|
Группа «диетотерапии» (n=53) |
Группа «диетотерапии и метформина» "Diet therapy and metformin" group (n=36) |
||
|
Генотип АА+АС (n=45) |
Генотип СС (n=8) |
Генотип АА+АС (n=32) |
Генотип СС Genotype CC (n=4) |
|
|
Избыток массы тела |
40,0 |
37,5 |
28,1 |
50,0 |
|
Ожирение 1 ст. |
35,5 |
25 |
31,2 |
25,0 |
|
Ожирение 2 ст. |
20,0 |
25 |
25,0 |
25,0 |
|
Ожирение 3 ст. |
4,5 |
12,5 |
15,7 |
0,0 |
Таблица / Table 3
Распределение НУО в исследуемых группах (%)
Distribution of early metabolism disorders in the study groups (%)
|
|
Группа «диетотерапии» (n=53) |
Группа «диетотерапии и метформина» "Diet therapy and metformin" group (n=36) |
||
|
Генотип АА+АС (n=45) |
Генотип СС (n=8) |
Генотип АА+АС (n=32) |
Генотип СС Genotype CC (n=4) |
|
|
Норма |
82,2 |
62,5 |
12,5 |
25,0 |
|
Нарушение гликемии натощак |
6,7 |
12,5 |
6,2 |
0,0 |
|
Нарушение толерантности к глюкозе |
8,8 |
12,5 |
37,5 |
25,0 |
|
Впервые выявленный СД2 |
2,3 |
12,5 |
43,8 |
50,0 |
При отсутствии учёта метода лечения ассоциации носительства аллеля А rs622342 SLC22A1 с изменениями биохимических показателей крови пациенток нами выявлено не было (табл. 4).
Таблица / Table 4
Взаимосвязь аллеля А rs622342 SLC22A1 с изменениями биохимических показателей крови пациентов без учета метода выбранной терапии
Association of A-allele of rs622342 SLC22A1 with changes in biochemical blood parameters of patients without taking into account the method of chosen therapy
|
Показатель |
Изменение показателей (в % от первого измерения) |
Значение |
|
|
Генотип АА+АС |
Генотип СС (n=11) |
||
|
HbA1C |
-1,87 [-5,88; 3,44] |
-0,29 [-5,76; 5,17] |
0,825 |
|
Глюкоза |
-6,01 [-16,29; 13,55] |
0,02 [-27,12; 12,48] |
0,890 |
|
Общий холестерин |
-2,01 [-19,71; 17,64] |
-9,21 [-36,24; 19,75] |
0,551 |
|
ЛПВП |
7,05 [-21,39; 77,16] |
16,18 [-7,09; 65,11] |
0,634 |
|
ЛПНП |
-9,09 [-34,85; 42,11] |
-41,64 [-49,32; 13,57] |
0,237 |
|
ТГ |
-7,16 [-24,35; 34,86] |
-60,46 [-61,01; -44,68] |
0,131 |
В группе «диетотерапии» среди гомозиготных носительниц аллеля С по сравнению с носительницами аллеля А rs622342 SLC22A1 наблюдалось более выраженное снижение уровня общего холестерина и триглицеридов через 3 месяца от начала наблюдения (рис. 1, 2), при том что различий в снижении уровней ЛПВП, ЛПНП не отмечалось. Значимых различий в динамике уровней гликированного гемоглобина, тощаковой глюкозы выявлено не было (табл. 5).
Таблица / Table 5
Взаимосвязь аллеля А rs622342 SLC22A1 с изменениями биохимических показателей крови пациентов в группе «диетотерапии»
Association of A-allele of rs622342 SLC22A1 with changes in biochemical blood parameters of patients in the «diet therapy» group
|
Показатель |
Изменение показателей (в % от первого измерения) Change in indicators (in % from the first measurement) |
Значение |
|
|
Генотип АА+АС |
Генотип СС (n=8) |
||
|
HbA1C |
-0,89 [-4,35; 5,31] |
-3,59 [-10,15; 5,16] |
0,321 |
|
Глюкоза |
-2,11 [-14,81; 16,27] |
-17,06 [-27,41; 1,41] |
0,341 |
|
Общий холестерин |
0,93 [-19,71; 25,14] |
-46,69 [-57,15; -36,24] |
0,036 |
|
ЛПВП |
2,87 [-20,48; 77,68] |
-7,09 [-9,75; 11,41] |
0,739 |
|
ЛПНП |
-15,09 [-36,84; 32,97] |
-47,05 [-48,64; 36,14] |
0,820 |
|
ТГ |
-5,54 [-17,37; 43,41] |
-73,71 [-86,95; -60,46] |
0,038 |
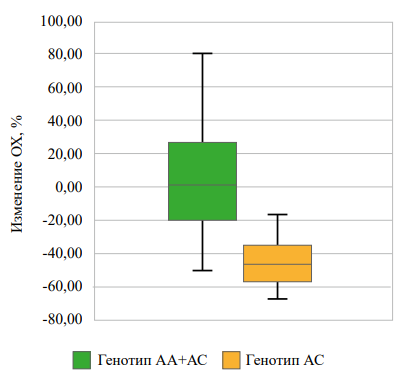
Рисунок 1. Взаимосвязь rs622342 SLC22A1 с изменением уровня ОХ через 3 месяца наблюдений в группе «диетотерапии».
Figure 1. Association of rs622342 SLC22A1 with changes in total cholesterol level after 3 months of observation in the «diet therapy» group.
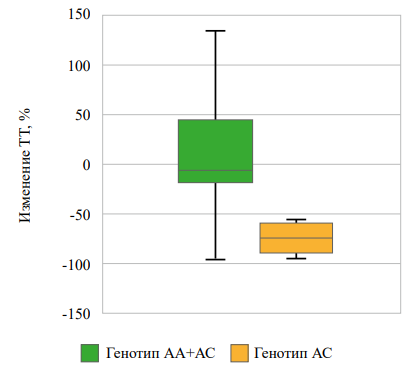
Рисунок 2. Взаимосвязь rs622342 SLC22A1 с изменением уровня ТГ через 3 месяца наблюдений в группе «диетотерапии».
Figure 2. Association of rs622342 SLC22A1 with changes in triglycerides level after 3 months of observation in the «diet therapy» group.
В группе «диетотерапии и метформина» значимых различий в динамике показателей жирового и углеводного обменов среди носительниц аллеля А и генотипа СС обнаружено не было (табл. 6).
Таблица / Table 6
Взаимосвязь аллеля А rs622342 SLC22A1 с изменениями биохимических показателей крови пациентов в группе «диетотерапии и метформина»
Association of A-allele of rs622342 SLC22A1 with changes in biochemical blood parameters of patients in the «diet therapy and metformin» group
|
Показатель |
Изменение показателей (в % от первого измерения) Change in indicators (in % from the first measurement) |
Значение |
|
|
Генотип АА+АС |
Генотип СС (n=4) |
||
|
HbA1C |
-2,42 [ -6,89; -2,39] |
|
0,108 |
|
Глюкоза |
-11,57 [ -17,16; 9,15] |
8,53 [ -18,59; 31,52] |
0,440 |
|
Общий холестерин |
-4,78 [ -21,32; 4,57] |
9,88 [ -9,21; 25,22] |
0,289 |
|
ЛПВП |
8,45 [ -22,14; 74,24] |
65,11 [ 33,76; 118,63] |
0,353 |
|
ЛПНП |
12,82 [ -32,86; 17,77] |
-36,23 [ -56,91; -23,11] |
0,128 |
|
ТГ |
-12,63 [ -51,08; 19,71] |
-44,68 [ -52,84; 24,62] |
0,896 |
Обсуждение
В процессе анализа данных литературы мы выявили несколько противоположных мнений различных групп авторов о взаимосвязи rs622342 SLC22A1 с изменениями биохимических показателей крови. В ходе работы, проведённой среди представителей мексиканской популяции, Res´endiz-Abarca et al. выявили существенное снижение уровня HbA1C среди носителей аллеля А относительно гомозигот СС rs622342 SLC22A1 через 3 и 6 месяцев от начала наблюдения [10]. В исследовании Tkáč et al., проведённом на европейской популяции, связи rs622342 SLC22A1 с динамикой показателей углеводного обмена выявлено не было [11]. Проведённое нами исследование охватывало коренное население Республики Татарстан, в генетическом составе которого преобладает европеоидный компонент [12], и нами так же не было выявлено ассоциации полиморфного маркера rs622342 SLC22A1 с изменениями показателей углеводного обмена.
Взаимосвязь rs622342 SLC22A1 с изменениями липидных фракций остаётся малоизученной. Так, в ходе анализа литературы нами было найдено лишь одно исследование, в котором был освещён данный вопрос. В ходе исследования, проведённого среди индийского населения, не было выявлено ассоциации данного полиморфизма с изменениями уровней ОХ, ТГ, ЛПНП и ЛПВП через 3 месяца от начала приёма метформина [13], что согласовывается с полученными нами результатами. При этом мы обнаружили существенное снижение уровней ОХ и ТГ среди гомозиготных носительниц СС, не принимавших метформин, что может свидетельствовать о нивелировании липидоснижающего эффекта диетотерапии при назначении метформина данной категории пациентов. Дальнейшее расширение выборки в частности за счёт включения в исследование мужчин позволит определить, насколько полученные результаты применимы для европейской популяции в целом.
Выводы
- Среди носительниц СС-генотипа rs622342 SLC22A1 наблюдается значимое снижение уровней общего холестерина, триглицеридов по сравнению с носительницами аллеля А через 3 месяца общепринятой при нарушениях углеводного обмена диетотерапии.
- При добавлении метформина к немедикаментозной схеме лечения ранних НУО данных изменений липидограммы между носителями различных вариантов rs622342 SLC22A1 не наблюдается.
Список литературы
1. Global report on diabetes. Geneva: World Health Organization 2018. License: CC BY-NC-SA 3.0 IGO.
2. Дедов И.И., Шестакова М.В., Галстян Г.Р. Распространенность сахарного диабета 2 типа у взрослого населения России (исследование NATION). Сахарный диабет. 2016;19(2):104-112. https://doi.org/10.14341/DM2004116-17
3. Барбараш О.Л., Воевода М.И., Галстян Г.Р., Шестакова М.В., Бойцов С.А., и др. Предиабет как междисциплинарная проблема: определение, риски, подходы к диагностике и профилактике сахарного диабета 2 типа и сердечно-сосудистых осложнений. Российский кардиологический журнал. 2019;(4):83-91. https://doi.org/10.15829/1560-4071-2019-4-83-91
4. Гринева Е.Н., Мазуров В.И., Халимов Ю.Ш., Бакулин И.Г., Панов А.В., и др. Проект резолюции Экспертного Совета главных специалистов СЗФО по выявлению предиабета и профилактике сахарного диабета 2-го типа и связанных с ним заболеваний сердечно-сосудистой системы, печени, опорно-двигательного аппарата. Артериальная гипертензия. 2019;25(6):693-699. https://doi.org/10.18705/1607-419X-2019-25-6-693-699
5. Дедов И.И., Шестакова М.В., Майоров А.Ю., Мокрышева Н.Г., Андреева Е.Н., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под редакцией И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. 11-й выпуск. Сахарный диабет. 2023;26(2S):1-157. https://doi.org/10.14341/DM13042
6. Теплова А.С., Титова В.В., Тенчурина А.И. Биохимические основы органо-протективных свойств метформина. FOCUS. Эндокринология. 2024;5(1):59-64. https://doi.org/10.62751/2713-0177-2024-5-1-08
7. Поздняков Н.О., Каграманян И.Н., Мирошников А.Е., Емельянов Е.С., Груздева А.А., и др. Фармакогенетические аспекты в терапии сахарного диабета 2-го типа. Acta Biomedica Scientifica. 2020;5(3):13-23. https://doi.org/10.29413/ABS.2020-5.3.2
8. Graham GG, Punt J, Arora M, Day RO, Doogue MP, et al. Clinical pharmacokinetics of metformin. Clin Pharmacokinet. 2011;50(2):81-98. https://doi.org/10.2165/11534750-000000000-00000
9. Mofo Mato EP, Guewo-Fokeng M, Essop MF, Owira PMO. Genetic polymorphisms of organic cation transporter 1 (OCT1) and responses to metformin therapy in individuals with type 2 diabetes: A systematic review. Medicine (Baltimore). 2018;97(27):e11349. https://doi.org/10.1097/MD.0000000000011349
10. Reséndiz-Abarca CA, Flores-Alfaro E, Suárez-Sánchez F, Cruz M, Valladares-Salgado A, Del Carmen Alarcón-Romero L, Vázquez-Moreno MA, Wacher-Rodarte NA, Gómez-Zamudio JH. Altered Glycemic Control Associated With Polymorphisms in the SLC22A1 (OCT1) Gene in a Mexican Population With Type 2 Diabetes Mellitus Treated With Metformin: A Cohort Study. J Clin Pharmacol. 2019;59(10):1384-1390. https://doi.org/10.1002/jcph.1425
11. Tkáč I, Klimčáková L, Javorský M, Fabianová M, Schroner Z, et al. Pharmacogenomic association between a variant in SLC47A1 gene and therapeutic response to metformin in type 2 diabetes. Diabetes Obes Metab. 2013;15(2):189-191. https://doi.org/10.1111/j.1463-1326.2012.01691.x
12. Кравцова О.А. Структура ядерного генофонда поволжских татар (по данным аутосомных микросателлитных локусов). Ученые записки Казанского университета. Серия Естественные науки. 2007;149(2):138-147. eLIBRARY ID: 11136942 EDN: JJSLRF
13. Umamaheswaran G, Praveen RG, Damodaran SE, Das AK, Adithan C. Influence of SLC22A1 rs622342 genetic polymorphism on metformin response in South Indian type 2 diabetes mellitus patients. Clin Exp Med. 2015;15(4):511-517. https://doi.org/10.1007/s10238-014-0322-5
Об авторах
Ф. В. ВалееваРоссия
Валеева Фарида Вадутовна, д.м.н., профессор, заведующая кафедрой эндокринологии
Казань
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
М. С. Медведева
Россия
Медведева Мария Сергеевна, врач-эндокринолог
Казань
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Т. А. Киселева
Россия
Киселева Татьяна Александровна, к.м.н., доцент кафедры эндокринологии
Казань
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
К. Б. Хасанова
Россия
Хасанова Камиля Булатовна, к.м.н., ассистент кафедры эндокринологии
Казань
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Р. М. Набиуллина
Россия
Набиуллина Роза Муллаяновна, к.м.н., доцент кафедры биохимии и клинической лабораторной диагностики
Казань
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Валеева Ф.В., Медведева М.С., Киселева Т.А., Хасанова К.Б., Набиуллина Р.М. Взаимосвязь полиморфизма rs622342 SLC22A1 с краткосрочными изменениями показателей метаболизма жиров и углеводов при различных вариантах терапии ранних нарушений углеводного обмена у женщин. Медицинский вестник Юга России. 2025;16(1):39-45. https://doi.org/10.21886/2219-8075-2025-16-1-39-45
For citation:
Valeeva F.V., Medvedeva M.S., Kiseleva T.A., Khasanova K.B., Nabiullina R.M. Association of rs622342 SLC22A1 with the short-term changes of lipid and carbohydrate metabolism indicators in different variants of early carbohydrate metabolism disorders management in women. Medical Herald of the South of Russia. 2025;16(1):39-45. (In Russ.) https://doi.org/10.21886/2219-8075-2025-16-1-39-45
JATS XML







































