Перейти к:
Предикторы неблагоприятного течения и прогноза у пациентов с сердечной недостаточностью с сохраненной фракцией выброса левого желудочка
https://doi.org/10.21886/2219-8075-2024-15-4-38-48
Аннотация
Сердечная недостаточность с сохранённой фракцией выброса (СНсФВ) является наиболее распространённой формой сердечной недостаточности (СН) во всём мире и характеризуется тяжёлым течением, неблагоприятным прогнозом, а также ограниченностью эффективных методов лечения. На сегодняшний день отсутствуют надежные прогностические алгоритмы, позволяющие выявлять больных высокого риска, а прогностическая значимость определена лишь для общепринятых клинических и стандартных эхокардиографических показателей в покое. Обнаружение независимых предикторов неблагоприятного прогноза/тяжёлого течения СНсФВ имеет важное значение для определения индивидуальной тактики лечения таких пациентов. В статье изложен обзор зарубежных и отечественных исследований, посвящённых определению клинических, биохимических и гемодинамических предикторов неблагоприятного прогноза и течения СНсФВ. Показано значение оценки этих предикторов для определения прогноза и выбора оптимального лечения пациентов с СНсФВ. Определены направления дальнейших исследований на выделение фенотипов СНсФВ и разработку персонализированной терапии, а также на построение прогностических моделей, позволяющих выявлять пациентов с высоким риском, которым требуется более тщательное наблюдение и/или более интенсивное медикаментозное лечение.
Ключевые слова
Для цитирования:
Соболевская М.С., Гвоздева А.Д., Свирида О.Н., Филатова А.Ю. Предикторы неблагоприятного течения и прогноза у пациентов с сердечной недостаточностью с сохраненной фракцией выброса левого желудочка. Медицинский вестник Юга России. 2024;15(4):38-48. https://doi.org/10.21886/2219-8075-2024-15-4-38-48
For citation:
Sobolevskaya M.S., Gvozdeva A.D., Svirida O.N., Filatova A.Y. Predictors of unfavorable progression and prognosis in patients with heart failure with preserved left ventricular ejection fraction. Medical Herald of the South of Russia. 2024;15(4):38-48. (In Russ.) https://doi.org/10.21886/2219-8075-2024-15-4-38-48
Введение
Распространённость хронической сердечной недостаточности с сохранённой фракцией выброса (СНсФВ) ежегодно растёт, и на сегодняшний день более половины всех пациентов с сердечной недостаточностью (СН) имеет сохранённую фракцию выброса (ФВ) левого желудочка (ЛЖ) [1][2]. СНсФВ характеризуется высокой частотой госпитализаций и смертностью: согласно обсервационным исследованиям, каждый второй больной с СНсФВ повторно попадает в больницу в течение первого полугода после выписки, а 5-летняя смертность среди больных с СНсФВ, выписавшихся из стационара, достигает 65% [1]. В отличие от СН со сниженной ФВ ЛЖ, методы лечения, улучшающие прогноз при СНсФВ, в настоящее время ограничены. Это во многом связано с гетерогенностью пациентов, а также со сложностью диагностики СНсФВ, что повлияло на результаты основных клинических исследований, посвящённых терапии этого состояния [3]. В настоящее время продолжаются исследования, посвящённые выделению определённых фенотипов СНсФВ и разработке персонализированной терапии для них, а также совершенствованию алгоритмов диагностики СНсФВ.
Важной задачей в лечении СНсФВ также является разработка надёжных прогностических моделей, которые позволили бы не только заранее выявить пациентов из группы высокого риска, но и выбрать оптимальный метод лечения и дальнейшего наблюдения пациентов. Кроме того, определение факторов, способствующих неблагоприятному прогнозу, может помочь разработке новых таргетных методов лечения СНсФВ.
Целью настоящего обзора являлась оценка роли основных имеющихся клинических, гемодинамических и биохимических маркеров неблагоприятного прогноза при СНсФВ. Был проведён поиск оригинальных исследований и систематических обзоров, посвящённых оценке прогноза СНсФВ и опубликованных с 1 января 2000 г. до 1 мая 2024 г. Поиск осуществлялся в базах данных «PubMed/MEDLINE» (для англоязычных публикаций) и «РИНЦ» (для исследований на русском языке). В качестве поисковых слов были использованы «сердечная недостаточность», «сохраненная фракция выброса», «левый желудочек», «предикторы», «прогностическая значимость».
Клинические предикторы неблагоприятного прогноза и течения СНсФВ
Согласно обсервационным исследованиям, пожилой возраст, а также наличие сопутствующих заболеваний являются факторами риска неблагоприятного прогноза при СНсФВ. Полиморбидность является отличительной чертой пациентов с СНсФВ. По мере старения наблюдается увеличение числа сопутствующих заболеваний, таких как анемия, хроническая болезнь почек, хроническая обструктивная болезнь лёгких, сахарный диабет, которые осложняют лечение и могут способствовать неблагоприятным исходам [4].
Доказано, что артериальная гипертензия является одним из основных факторов риска развития СН и ассоциируется с неблагоприятным прогнозом. Согласно Фремингемскому исследованию, 91% участников с СН страдает артериальной гипертензией [5]. Современные модели прогнозирования риска показывают, что повышенное систолическое артериальное давление и повышенное диастолическое артериальное давление связаны с частотой наступления конечных точек при СНсФВ [6]. Кроме того, повышение пульсового артериального давления также является фактором риска неблагоприятного прогноза [7].
Гипертрофия левого желудочка (ГЛЖ) является частым осложнением артериальной гипертензии и мощным фактором риска развития СН. Исследованиями Ovchinnikov AG et al. с бессимптомными пациентами с ГЛЖ показано, что в течение 8 лет наблюдения у 72% пациентов успела развиться СНсФВ [8]. ГЛЖ способствует развитию и прогрессированию диастолической дисфункции левого желудочка путём замедления расслабления миокарда, повышения жесткости кардиомиоцитов и избыточного отложения коллагена в интерстициальном пространстве миокарда. Кроме того, наличие ГЛЖ повышает риск развития нарушений ритма сердца, таких как фибрилляция предсердий (ФП) и желудочковые аритмии [9]. По данным ряда исследований, выраженность ГЛЖ коррелирует с неблагоприятным прогнозом при СНсФВ. Так, в крупном исследовании PARAGON-HF ГЛЖ являлась независимым предиктором госпитализаций по поводу СН и сердечно-сосудистой смертности у пациентов с СНсФВ [10].
Ожирение, равно как и недостаток массы тела, является значимым фактором, влияющими на прогноз у пациентов с СНсФВ. В ряде исследований была выявлена U-образная зависимость между значением индекса массы тела и комбинированной конечной точкой (смертность и госпитализации по поводу СН), где наибольшему риску были подвержены пациенты с индексом массы тела менее 23,5 кг/м² и более 35 кг/м² [11][12]. У пациентов с ожирением и метаболическим синдромом наблюдается повышенный риск развития сердечно-сосудистых событий и госпитализаций по поводу СН [13]. Низкий уровень физической активности также связан с неблагоприятными исходами: было показано, что соблюдение минимального рекомендованного уровня физической активности как минимум дважды в неделю приводило к снижению риска неблагоприятного прогноза на 19% по сравнению с пациентами с СНсФВ, не придерживавшихся рекомендаций [14].
Сахарный диабет 2 типа является независимым фактором риска развития СНсФВ, а больным, уже имеющим СНсФВ, значительно ухудшает её течение [15]. Для пациентов с СНсФВ, страдающих сахарным диабетом 2 типа, характерны более низкий уровень качества жизни, повышенная частота госпитализаций и высокий риск сердечно-сосудистых осложнений [16]. По данным крупного регистра, у пациентов с СН и сахарным диабетом 2 типа, госпитализированных по поводу декомпенсации СН, показатель трёхлетней выживаемости оказался на 28% ниже, чем у пациентов без диабета [17].
Одним из частых осложнений СНсФВ является ФП. Согласно данным эпидемиологических исследований, у двух третей пациентов с СНсФВ рано или поздно развивается ФП. При этом возникновение ФП ассоциировано с ухудшением симптомов СН, снижением качества жизни, а также с увеличением риска госпитализаций по поводу СН и смертности по сравнению с пациентами с синусовым ритмом. Xie Z et al. показали, что катетерная аблация ФП у пациентов с СНсФВ ассоциируется с улучшением прогноза [18].
Выраженность симптомов СН, а также более высокий функциональный класс СН (по NYHA) в значительной степени определяют прогноз пациентов [19]. Dalos D et al. показали, что пациенты с СНсФВ, имеющие III–IV функциональные классы (по NYHA), достоверно чаще достигали комбинированной конечной точки (включающей госпитализации по поводу СН и смертность от ССЗ) по сравнению с пациентами, имеющими II функциональный класс. Стоит отметить, что в данном исследовании диагноз «СНсФВ» был установлен на основании инвазивно измеренного давления заклинивания лёгочной артерии, при этом всем пациентам ангиографически исключали ишемическую болезнь сердца (которая часто сопутствует СНсФВ) [20]. Недавняя предшествующая госпитализация по поводу декомпенсации СН также является надёжным предиктором неблагоприятного прогноза. Установлено, что пациенты с СНсФВ, недавней госпитализацией по поводу обострения СН и более тяжёлыми симптомами имеют высокий риск последующих повторных госпитализаций и смерти [21].
Биохимические предикторы неблагоприятного прогноза и течения СНсФВ
Определение биомаркеров играет важную роль как для диагностики, так и для стратификации риска пациентов с СН. Хотя основным компонентом шкал прогнозирования риска при СН являются натрийуретические пептиды (НУП), число маркеров, отражающих те или иные патофизиологические механизмы, задействованные при СНсФВ, продолжает расти.
Биологически активный натрийуретический пептид B-типа (BNP) и его неактивный N-концевой фрагмент (NT-proBNP) синтезируются в миокарде желудочков в ответ на растяжение кардиомиоцитов и/или перегрузку давлением. Основными физиологическими эффектами BNP являются натрийурез, вазодилатация, подавление активности ренин-ангиотензин-альдостероновой системы и симпатической нервной системы [22]. Определение уровня НУП широко используется для диагностики, а также для оценки прогноза при СН, в том числе при СНсФВ. В исследованиях PARAGON-HF и I-PRESERVE NT-proBNP являлся надёжным предиктором смертности от сердечно-сосудистых заболеваний и госпитализаций по поводу СН [23][24]. Jhund PS et al. также провели анализ исследования I-PRESERVE и показали, что повышение концентрации NT-proBNP в динамике было связано с увеличением риска смерти от сердечно-сосудистых заболеваний или госпитализации по поводу СН, а снижение — с тенденцией к снижению этого риска [25].
Однако хорошо известно, что НУП отражают лишь одно из многих важных звеньев патогенеза СН. Интерпретация результатов определения концентрации этих пептидов зачастую бывает затруднена ввиду зависимости концентрации НУП от функции почек, индекса массы тела, тиреоидного статуса, возраста и пола пациентов [26]. Кроме того, известно, что при сопоставимом риске неблагоприятных исходов, уровень НУП у пациентов с СНсФВ может быть в несколько раз ниже по сравнению с пациентами с сердечной недостаточностью с низкой фракцией выброса (СНнФВ) [27]. Это определяет актуальность поиска новых, современных маркеров оценки прогноза и эффективности терапии при СНсФВ.
Определение уровня сердечных тропонинов является золотым стандартом диагностики повреждения миокарда. Несмотря на то, что прогностическая значимость сердечных тропонинов при СНсФВ изучена в меньшей степени, чем при СНнФВ, было показано, что у пациентов с СНсФВ повышенные уровни высокочувствительного тропонина I (вч-тропонина) коррелируют с более высоким риском внутрибольничной смертности, большей продолжительностью госпитализации и риском повторной госпитализации по поводу СН [28]. Кроме того, вторичный анализ 34233 пациентов, поступивших в стационар по поводу декомпенсации СНсФВ, продемонстрировал повышенный риск 30-дневной смертности, 30-дневной повторной госпитализации и смертности в течение 1 года после выписки у пациентов с повышенным уровнем вч-тропонина I [29]. Было показано, что комбинация NT-proBNP и вч-тропонина T добавляет дополнительную и независимую прогностическую информацию при СН. В частности, при СНнФВ на основании результатов исследования EMPEROR-Reduced была разработана надежная модель риска неблагоприятных исходов на основе биомаркеров, а именно сочетания NT-proBNP и вч-тропонина-Т [30]. Прогностическая значимость комбинации NT-proBNP и вч-тропонина T также была установлена и на основании данных исследования EMPEROR-Preserved, включавших пациентов с СНсФВ [31].
Одну из ключевых ролей в развитии и прогрессировании СНсФВ играет хроническое системное воспаление. По данным исследований биомаркеров при СНсФВ, по сравнению с СНнФВ наблюдался более высокий уровень маркеров воспаления, таких как высокочувствительный С-реактивный белок (вчСРБ), интерлейкин-6, фактор некроза опухоли-α и др [32]. При этом в отношении ряда маркеров была выявлена связь с тяжестью течения и неблагоприятным прогнозом СНсФВ. В нескольких работах была показана связь между повышенным уровнем вчСРБ и риском неблагоприятных исходов при СНсФВ, в том числе после поправки на уровни НУП [33][34]. Более поздние исследования выявили более сильную прогностическую значимость при СНсФВ по сравнению с СНнФВ уровня СРБ как для смертности от всех причин, так и для смертности от сердечно-сосудистых заболеваний [35].
Фактор дифференцировки роста-15 (GDF-15), представляющий собой маркер воспаления, экспрессируется в различных типах клеток в ответ на повреждение ткани, ишемию или стресс. Исследования показали, что повышенный уровень GDF-15 в крови является независимым фактором риска сердечно-сосудистых событий, смерти от всех причин, повторной госпитализации по поводу СН и комбинированной конечной точки (смерть от всех причин и первая госпитализация по поводу СН) у пациентов с СНсФВ, и его прогностическое значение может быть выше, чем у NT-proBNP [36][37].
Эндотелиальная дисфункция является одним из ключевых звеньев патогенеза СНсФВ. Фактор фон Виллебранда представляет собой гликопротеин, секретируемый эндотелиальными клетками сосудов и мегакариоцитами, и считается маркером повреждения и дисфункции эндотелиальных клеток. В исследовании Kleber ME et al. фактор фон Виллебранда служил независимым фактором риска смертности от всех причин у пациентов с СНсФВ после поправки на возраст, пол, индекс массы тела, NT-proBNP, функцию почек [38].
N-оксид триметиламина (ТМАО) является одним из важных метаболитов кишечной флоры, и процесс его метаболизма тесно связан с возникновением сердечно-сосудистых заболеваний. Повышенные уровни ТМАО могут ускорить прогрессирование СН, провоцируя окислительный стресс и воспаление, способствуя фиброзу миокарда, влияя на митохондриальный энергетический обмен и другие процессы [39]. Dong Z et al. определили, что уровни ТМАО в плазме у пациентов с СНсФВ значительно превосходили таковые у контрольной группы, не имеющей СН [40]. В экспериментальных исследованиях на мышиных моделях СНсФВ была выявлена связь циркулирующего ТМАО с выраженностью фиброза миокарда и диастолической дисфункции ЛЖ [41]. Данные о прогностическом значении ТМАО при СНсФВ противоречивы. Schuett K et al. не выявили корреляции между уровнем ТМАО в крови и прогнозом при СНсФВ [42]. Однако в ряде исследований повышение концентрации ТМАО в сыворотке крове было связано с риском неблагоприятных исходов, в том числе смертности и госпитализаций по поводу СН [43][44].
Остеопонтин представляет собой белок, участвующий в передаче сигналов между кардиомиоцитами и компонентами внеклеточного матрикса, регуляции ангиогенеза и репарации тканей, способствующий превращению фибробластов в миофибробласты и синтезу белков внеклеточного матрикса. Повышенная экспрессия остеопонтина связана с прогрессированием фиброза и увеличением риска развития СН [45]. В исследовании Tromp J и соавт, продемонстрирована прогностическая значимость остеопонтина в отношении смертности от всех причин и риска повторных госпитализаций по поводу СН в течение 18 месяцев при СНсФВ, но не при СНнФВ [32]. В многовариантной прогностической модели при СНсФВ, которая включала демографические, клинические и биохимические параметры, концентрация остеопонтина в плазме оказалась независимым предиктором смерти от всех причин [46].
Оценка маркеров фиброза и ремоделирования миокарда играет важную роль в представлении о патофизиологии СНсФВ. Экспериментальные и клинические исследования демонстрируют связь галектина-3 с развитием СН и участие его в различных процессах, которые играют роль в патогенезе СНсФВ, включая пролиферацию миофибробластов, фиброгенез, воспаление, ремоделирование сердца и сосудов [47]. В исследовании Wu et al. уровни галектина-3 как в плазме, так и в миокарде коррелировали с тяжестью диастолической дисфункции [48]. На сегодняшний день прогностическая значимость галектина-3 была доказана в нескольких исследованиях с участием пациентов с СНсФВ. В исследовании PRIDE уровень галектина-3 в плазме коррелировал с повышенным давлением наполнения (более высоким соотношением E/e') [49]. Кроме того, самые высокие уровни галектина-3 в крови были связаны с более высоким риском 4-летней смертности независимо от размеров и функции ЛЖ [50].
ST2-рецептор, относящийся к семейству рецепторов интерлейкина-1, продуцируется фибробластами и кардиомиоцитами в ответ на растяжение кардиомиоцитов и/или перегрузку давлением. Установлено, что высокий уровень растворимого ST2 ассоциирован с фиброзом миокарда, гипертрофией и неблагоприятным ремоделированием сердца [51]. Определение растворимого ST2 может быть полезным при стратификации риска пациентов с СНнФВ. К примеру, в исследовании PARADIGM-HF исходный уровень растворимого ST2 оказался независимым предиктором госпитализации по поводу СН, сердечно-сосудистой смерти и их комбинации [52]. Однако прогностическая значимость растворимого ST2 при СНсФВ неоднозначна: имеющиеся на сегодняшний день исследования носили в основном ретроспективный характер и значительно отличались по критериям включения [53].
Гемодинамические предикторы неблагоприятного прогноза и течения СНсФВ
Основным гемодинамическим нарушением при СНсФВ является повышение давления наполнения ЛЖ, обусловленное диастолической дисфункцией [54]. Повышенное давление наполнения ЛЖ является основной причиной сердечной одышки и низкой переносимости физической нагрузки у пациентов с СНсФВ. Было доказано, что прогноз у пациентов с СНсФВ зависит от выраженности нарушения диастолической функции и уровня давления наполнения ЛЖ в покое [55][56]. Однако при СНсФВ самым распространённым нарушением диастолической функции является изолированное замедление расслабления, при котором давление наполнения ЛЖ в покое обычно нормальное, эхокардиографические признаки повышения давления наполнения отсутствуют, а уровень мозгового натрийуретического гормона незначительно повышен или даже находится в пределах нормы [57]. К примеру, в исследовании Obokata M et al. было выявлено, что у 44% пациентов с СНсФВ давление наполнения ЛЖ (давление заклинивания в легочных капиллярах, оценённое с помощью катетеризации правых отделов сердца) составляло менее 15 мм рт. ст. в покое, при этом значительно возрастало при нагрузке (выше 25 мм рт. ст.) [58]. Поэтому у многих больных с СНсФВ оценить переносимость нагрузки и тяжесть заболевания можно лишь с помощью диастолического стресс-теста, в ходе которого можно в том числе оценить резервные возможности организма (прежде всего, диастолический, систолический, хронотропный, левопредсердный резервы), от сохранности которых зависит нормальная переносимость нагрузки. Согласно европейским рекомендациям по диагностике СНсФВ, проведение диастолического стресс-теста является важнейшим компонентом диагностического алгоритма СНсФВ [59].
В ряде исследований была показана высокая прогностическая значимость диастолического стресс-теста. Holland D. et al. установили, что повышение давления наполнения при нагрузке ассоциировано с неблагоприятным прогнозом при СНсФВ; при этом наихудший прогноз отмечался у лиц с ишемией миокарда при нагрузке [60]. В исследовании Shim C. et al. было показано, что у пациентов с повышением давления в легочной артерии при нагрузке соотношение E/ e′ >15 (то есть повышенное давление наполнения) при нагрузке в 50 ватт явилось независимым предиктором неблагоприятного прогноза [61]. В инвазивном исследовании Dorfs S. et al. обследовали 355 пациентов с подозрением на СНсФВ; было показано, что давление наполнения ЛЖ как в покое, так и на высоте нагрузки с высокой точностью предсказывает прогноз [56].
При СНсФВ основной причиной преждевременного прекращения нагрузки является повышение давления наполнения ЛЖ и отсутствие должного прироста скорости расслабления (снижение диастолического резерва). При этом у многих пациентов имеет место не только нарушение диастолического резерва, но и снижение систолического резерва, когда при нагрузке ЛЖ не в состоянии увеличить свою сократимость в должной степени. Исследования показали, что нарушение систолического резерва способствует снижению переносимости нагрузки, снижению присасывающего эффекта ЛЖ и сердечного выброса, а также повышению давления наполнения ЛЖ [62][63]. Kosmala W. et al. выявили, что нарушение как диастолического, так и систолического резервов являлись независимыми предикторами неблагоприятного прогноза и усиливали прогностическую значимость клинических показателей и NT-proBNP [64].
Однако, несмотря на ослабление диастолического резерва, у пациентов с бессимптомной диастолической дисфункцией нормальное наполнение ЛЖ поддерживается за счет усиления сократимости левого предсердия (ЛП) [64]. У пациентов с СНсФВ также ослаблен и резерв сокращения ЛП, и необходимый прирост наполнения ЛЖ при нагрузке становится возможен лишь за счёт роста среднего давления в ЛП. На ранних стадиях СНсФВ среднее давление в ЛП увеличивается только во время нагрузки, однако в дальнейшем за счёт повышения жесткости ЛП остается повышенным и в состоянии покоя [65]. Показано, что функциональные нарушения ЛП являются самыми ранними патофизиологическими нарушениями при переходе от бессимптомного течения заболевания к СНсФВ [66]. Увеличение размера ЛП является надёжным ультразвуковым показателем, отражающим дисфункцию и повышенное давление в полости ЛП, и служит предиктором неблагоприятного прогноза при СН, в том числе СНсФВ [67]. Однако оценка лишь объёмных показателей часто недостаточна для выявления дисфункции ЛП. Анализ деформации ЛП является надёжным методом выявления дисфункции ЛП, а снижение его резервуарной функции обладает прогностической значимостью при СНсФВ [68].
Хроническое повышение давления в ЛП приводит к патологическому ремоделированию легочного сосудистого русла, развитию лёгочной гипертензии и нередко, как следствие, дисфункции правого желудочка (ПЖ) [69]. Исследования демонстрируют тесную связь между лёгочной гипертензией и прогнозом при СНсФВ. В нескольких работах было установлено, что более высокое систолическое давление в лёгочной артерии коррелирует с увеличением числа повторных госпитализаций у пациентов с СНсФВ [70][71]. Кроме того, повышенное систолическое давление в ПЖ, а также снижение систолической функции ПЖ ассоциировано с более высоким риском смертности при СНсФВ [72][73]. Не случайно исследователями выделен отдельный фенотип СНсФВ — со смешанной пост-/прекапиллярной лёгочной гипертензией, характеризующийся более выраженным нарушением толерантности к физическим нагрузкам и худшим прогнозом [74].
Кроме того, у некоторых пациентов с СНсФВ присутствует ограничение лёгочного сосудистого резерва, которое проявляется как неспособность снизить лёгочное сосудистое сопротивление при нагрузке [62]. Было установлено, что нарушение легочного сосудистого резерва также связано с неблагоприятными клиническими исходами [75].
Функция ПЖ — одна из основных детерминант прогноза пациентов с СНсФВ и лёгочной гипертензией. В ряде работ описан вклад динамики систолической функции ПЖ в прогноз пациентов с СНсФВ. Результаты метаанализа автора Gorter TM et al. продемонстрировали, что снижение значения показателя систолической экскурсии кольца трикуспидального клапана (TAPSE) на 5 мм ассоциируется с увеличением риска госпитализаций по поводу СН на 38% и риска летального исхода на 26% у пациентов c СНсФВ [76]. В исследовании Melenovsky V. et al. наличие дисфункции ПЖ у пациентов с СНсФВ ассоциировалось с увеличением риска летального исхода от всех причин в 2,2 раза после поправки на уровень систолического давления в лёгочной артерии (СДЛА) [77]. Такой показатель, как правожелудочково-артериальное сопряжение, оценённое как отношение TAPSE к СДЛА, по данным эхокардиографии, также является мощным предиктором выживаемости у пациентов с СНсФВ. Значение TAPSE/СДЛА <0,35 мм/мм рт.ст. ассоциируется с десятикратным увеличением риска летального исхода у пациентов с СН [78].
Дисфункция ПЖ при СНсФВ не опосредована исключительно высокой постнагрузкой, обусловленной лёгочной гипертензией [79]. Многие пациенты с близким к нормальному давлению в лёгочной артерии в покое также имеют дисфункцию ПЖ. У пациентов с СНсФВ при сохранной функции ПЖ в покое встречается также ослабление правожелудочкового резерва, что подчеркивает тот факт, что патофизиология СНсФВ не ограничена лишь нарушением диастолической функции ЛЖ [64]. Дисфункция ПЖ связана с ремоделированием правых отделов сердца. Было показано, что увеличение диаметра, площади и толщины стенки ПЖ предсказывает неблагоприятный исход при СНсФВ [80].
При СНсФВ основной причиной преждевременного прекращения нагрузки является повышение давления наполнения ЛЖ и отсутствие должного прироста скорости расслабления (снижение диастолического резерва), однако у многих больных можно выявить и другие нарушения, каждое из которых вносит свою лепту в плохую переносимость нагрузок: недостаточный прирост сократимости обоих желудочков (снижение систолического резерва) и частоты сердечных сокращений (снижение хронотропного резерва), дисфункция левого предсердия (снижение предсердного резерва) и др. Больные с СНсФВ могут различаться по степени истощения этих резервов; прогностическая значимость этих различий не ясна.
Нами проведено исследование с участием 348 пациентов со стабильной СНсФВ II–III функционального класса по NYHA, медиана наблюдения составила 5,4 [ 3,5; 7,0] года. По результатам проведённого анализа было определено, что прогноз СНсФВ не зависел от величины давления наполнения ЛЖ (соотношения Е/e’) и сократимости правого желудочка (показателя TAPSE) в покое, но зависел от того, насколько сильно эти показатели изменялись при физической нагрузке (диастолическом стресс-тесте), то есть от состояния, соответственно, диастолического и правожелудочкового резервов (рис. 1) [81].
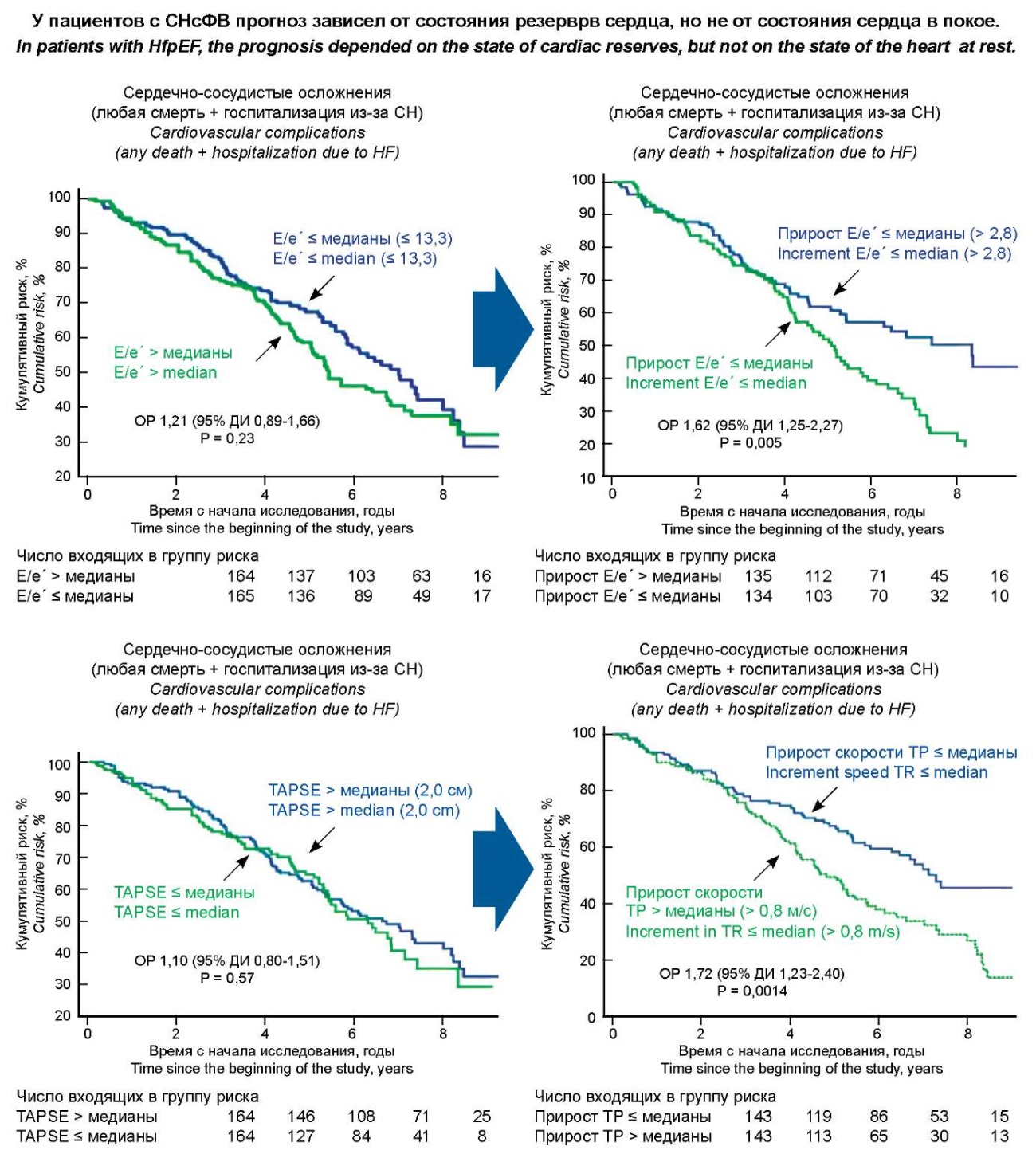
Рисунок 1. Влияния диастолического и правожелудочкового резервов сердца на прогноз СНсФВ.
Figure 1. The influence of diastolic and right ventricular reserves of the heart on the prognosis of HFpEF.
Заключение
В настоящем обзоре были рассмотрены различные клинические, гемодинамические и биохимические предикторы неблагоприятного прогноза и течения сердечной недостаточности с сохраненной фракцией выброса. На сегодняшний день возможности эффективного лечения СНсФВ ограничены, а прогностическая значимость определена лишь для общепринятых клинических и стандартных эхокардиографических показателей в покое. Недавние достижения в области ранней диагностики и подходов к лечению пациентов с СНсФВ, возможно, смогут способствовать улучшению прогноза и течения заболевания у таких больных. Обнаружение независимых предикторов неблагоприятного прогноза/тяжёлого течения СНсФВ позволит разработать прогностический алгоритм, с помощью которого можно будет выявлять больных, которым требуется более тщательное наблюдение и/или более интенсивное медикаментозное лечение.
Список литературы
1. Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association joint Committee on Clinical Practice Guidelines. Circulation. 2022;145(18):e895-e1032. Erratum in: Circulation. 2022;145(18):e1033. Erratum in: Circulation. 2022;146(13):e185. Erratum in: Circulation. 2023;147(14):e674. https://doi.org/10.1161/CIR.0000000000001063
2. Tsao Cw, Aday Aw, Almarzooq ZI, Alonso A, Beaton AZ, et al. Heart Disease and Stroke Statistics-2022 Update: A Report From the American Heart Association. Circulation. 2022;145(8):e153-e639. Erratum in: Circulation. 2022;146(10):e141. https://doi.org/10.1161/CIR.0000000000001052.
3. Агеев Ф.Т., Овчинников А.Г. Лечение пациентов с сердечной недостаточностью и сохраненной фракцией выброса: опора на клинические фенотипы. Кардиология. 2022;62(7):44-53. https://doi.org/10.18087/cardio.2022.7.n2058
4. Iorio A, Senni M, Barbati G, Greene Sj, Poli S, et al. Prevalence and prognostic impact of non-cardiac co-morbidities in heart failure outpatients with preserved and reduced ejection fraction: a community-based study. Eur J Heart Fail. 2018;20(9):1257-1266. https://doi.org/10.1002/ejhf.1202
5. Kenchaiah S, Vasan RS. Heart Failure in women--Insights from the Framingham Heart Study. Cardiovasc Drugs Ther. 2015;29(4):377-390. https://doi.org/10.1007/s10557-015-6599-0
6. Huang R, wu R, Lin Y, Zhong X, Ye X, et al. Time-averaged cumulative blood pressure and cardiovascular outcomes in heart failure with preserved ejection fraction: analysis from the Treatment of Preserved Cardiac Function Heart Failure with an Aldosterone Antagonist trial. J Hypertens. 2022;40(10):1918-1926. https://doi.org/10.1097/HjH.0000000000003177
7. Suzuki K, Claggett B, Minamisawa M, Nochioka K, Mitchell GF, et al. Pulse Pressure, Prognosis, and Influence of Sacubitril/Valsartan in Heart Failure with Preserved Ejection Fraction. Hypertension. 2021;77(2):546-556. https://doi.org/10.1161/HYPERTENSIONAHA.120.16277
8. Ovchinnikov A, Belyavskiy E, Potekhina A, Ageev F. Asymptomatic Leſt Ventricular Hypertrophy Is a Potent Risk Factor for the Development of HFpEF but Not HFrEF: Results of a Retrospective Cohort Study. J Clin Med. 2022;11(13):3885. https://doi.org/10.3390/jcm11133885
9. Garg P, Assadi H, jones R, Chan WB, Metherall P, et al. Leſt ventricular fibrosis and hypertrophy are associated with mortality in heart failure with preserved ejection fraction. Sci Rep. 2021;11(1):617. https://doi.org/10.1038/s41598-020-79729-6
10. Shah AM, Cikes M, Prasad N, Li G, Getchevski S, et al. Echocardiographic Features of Patients with Heart Failure and Preserved Leſt Ventricular Ejection Fraction. J Am Coll Cardiol. 2019;74(23):2858-2873. https://doi.org/10.1016/j.jacc.2019.09.063
11. Haass M, Kitzman DW, Anand IS, Miller A, Zile MR, et al. Body mass index and adverse cardiovascular outcomes in heart failure patients with preserved ejection fraction: results from the Irbesartan in Heart Failure with Preserved Ejection Fraction (I-PRESERVE) trial. Circ Heart Fail. 2011;4(3):324-331. https://doi.org/10.1161/CIRCHEARTFAILURE.110.959890
12. Pandey A, Berry JD, Drazner MH, Fang JC, Tang WHW, Grodin JL. Body Mass Index, Natriuretic Peptides, and Risk of Adverse Outcomes in Patients with Heart Failure and Preserved Ejection Fraction: Analysis From the TOPCAT Trial. J Am Heart Assoc. 2018;7(21):e009664. https://doi.org/10.1161/jAHA.118.009664
13. Voulgari C, Moyssakis I, Papazafiropoulou A, Perrea D, Kyriaki D, et al. The impact of metabolic syndrome on leſt ventricular myocardial performance. Diabetes Metab Res Rev. 2010;26(2):121-127. https://doi.org/10.1002/dmrr.1063
14. Pandey A, LaMonte M, Klein L, Ayers C, Psaty BM, et al. Relationship Between Physical Activity, Body Mass Index, and Risk of Heart Failure. J Am Coll Cardiol. 2017;69(9):1129-1142. https://doi.org/10.1016/j.jacc.2016.11.081
15. MacDonald MR, Petrie MC, Varyani F, Ostergren j, Michelson EL, et al. Impact of diabetes on outcomes in patients with low and preserved ejection fraction heart failure: an analysis of the Candesartan in Heart failure: Assessment of Reduction in Mortality and morbidity (CHARM) programme. Eur Heart J. 2008;29(11):1377-1385. https://doi.org/10.1093/eurheartj/ehn153
16. Kristensen SL, Mogensen UM, jhund PS, Petrie MC, Preiss D, et al. Clinical and Echocardiographic Characteristics and Cardiovascular Outcomes According to Diabetes Status in Patients with Heart Failure and Preserved Ejection Fraction: A Report From the I-Preserve Trial (Irbesartan in Heart Failure with Preserved Ejection Fraction). Circulation. 2017;135(8):724-735. https://doi.org/10.1161/CIRCULATIONAHA.116.024593
17. Bjorck LM, Lanitis M, Lappas G, Novak M, Rosengren A. Mortality Trends 1987 to 2004 in 404,480 Hospitalized Heart Failure Patients with and without Diabetes. Circulation. 2012;125:AP208. https://doi.org/10.1161/circ.125.suppl_10.AP208
18. Xie Z, Qi B, wang Z, Li F, Chen C, et al. Ablation for atrial fibrillation improves the outcomes in patients with heart failure with preserved ejection fraction. Europace. 2023;26(1):euad363. https://doi.org/10.1093/europace/euad363
19. Ahmed A, Aronow WS, Fleg JL. Higher New York Heart Association classes and increased mortality and hospitalization in patients with heart failure and preserved leſt ventricular function. Am Heart J. 2006;151(2):444-450. https://doi.org/10.1016/j.ahj.2005.03.066
20. Dalos D, Mascherbauer j, Zotter-Tufaro C, Duca F, Kammerlander AA, et al. Functional Status, Pulmonary Artery Pressure, and Clinical Outcomes in Heart Failure with Preserved Ejection Fraction. J Am Coll Cardiol. 2016;68(2):189-199. https://doi.org/10.1016/j.jacc.2016.04.052
21. Vaduganathan M, Claggett BL, Desai AS, Anker SD, Perrone SV, et al. Prior Heart Failure Hospitalization, Clinical Outcomes, and Response to Sacubitril/Valsartan Compared with Valsartan in HFpEF. J Am Coll Cardiol. 2020;75(3):245-254. https://doi.org/10.1016/j.jacc.2019.11.003
22. O'Meara E, de Denus S, Rouleau JL, Desai A. Circulating bio-markers in patients with heart failure and preserved ejection fraction. Curr Heart Fail Rep. 2013;10(4):350-358. https://doi.org/10.1007/s11897-013-0160-x
23. Solomon SD, McMurray JJV, Anand IS, Ge j, Lam CSP, et al. Angiotensin-Neprilysin Inhibition in Heart Failure with Preserved Ejection Fraction. N Engl J Med. 2019;381(17):1609-1620. https://doi.org/10.1056/NEjMoa1908655
24. Anand IS, Rector TS, Cleland JG, Kuskowski M, McKelvie RS, et al. Prognostic value of baseline plasma amino-terminal pro-brain natriuretic peptide and its interactions with irbesartan treatment effects in patients with heart failure and preserved ejection fraction: findings from the I-PRESERVE trial. Circ Heart Fail. 2011;4(5):569-577. https://doi.org/10.1161/CIRCHEARTFAILURE.111.962654
25. Jhund PS, Anand IS, Komajda M, Claggett BL, McKelvie RS, et al. Changes in N-terminal pro-B-type natriuretic peptide levels and outcomes in heart failure with preserved ejection fraction: an analysis of the I-Preserve study. Eur J Heart Fail. 2015;17(8):809-817. https://doi.org/10.1002/ejhf.274
26. Luchner A, Behrens G, Stritzke J, Markus M, Stark K, et al. Long-term pattern of brain natriuretic peptide and N-terminal pro brain natriuretic peptide and its determinants in the general population: contribution of age, gender, and cardiac and extra-cardiac factors. Eur J Heart Fail. 2013;15(8):859-867. https://doi.org/10.1093/eurjhf/hſt048
27. Shah SJ, Kitzman DW, Borlaug BA, van Heerebeek L, Zile MR, et al. Phenotype-Specific Treatment of Heart Failure with Preserved Ejection Fraction: A Multiorgan Roadmap. Circulation. 2016;134(1):73-90. https://doi.org/10.1161/CIRCULATIONAHA.116.021884
28. Okuyama R, Ishii J, Takahashi H, Kawai H, Muramatsu T, et al. Combination of high-sensitivity troponin I and N-terminal pro-B-type natriuretic peptide predicts future hospital admission for heart failure in high-risk hypertensive patients with preserved leſt ventricular ejection fraction. Heart Vessels. 2017;32(7):880-892. https://doi.org/10.1007/s00380-017-0948-9
29. Pandey A, Golwala H, Sheng S, DeVore AD, Hernandez AF, et al. Factors Associated with and Prognostic Implications of Cardiac Troponin Elevation in Decompensated Heart Failure with Preserved Ejection Fraction: Findings From the American Heart Association Get with The Guidelines-Heart Failure Program. JAMA Cardiol. 2017;2(2):136-145. https://doi.org/10.1001/jamacardio.2016.4726
30. Pocock SJ, Ferreira JP, Gregson j, Anker SD, Butler J, et al. Novel biomarker-driven prognostic models to predict morbidity and mortality in chronic heart failure: the EMPEROR-Reduced trial. Eur Heart J. 2021;42(43):4455-4464. https://doi.org/10.1093/eurheartj/ehab579
31. Pocock SJ, Ferreira JP, Packer M, Zannad F, Filippatos G, et al. Biomarker-driven prognostic models in chronic heart failure with preserved ejection fraction: the EMPEROR-Preserved trial. Eur J Heart Fail. 2022;24(10):1869-1878. https://doi.org/10.1002/ejhf.2607
32. Tromp J, Khan MA, Klip IT, Meyer S, de Boer RA, et al. Biomarker Profiles in Heart Failure Patients with Preserved and Reduced Ejection Fraction. J Am Heart Assoc. 2017;6(4):e003989. https://doi.org/10.1161/jAHA.116.003989
33. Gottdiener JS, Arnold AM, Aurigemma GP, Polak JF, Tracy RP, et al. Predictors of congestive heart failure in the elderly: the Cardiovascular Health Study. J Am Coll Cardiol. 2000;35(6):1628-1637. https://doi.org/10.1016/s0735-1097(00)00582-9
34. Tromp J, westenbrink BD, Ouwerkerk W, van Veldhuisen DJ, Samani NJ, et al. Identifying Pathophysiological Mechanisms in Heart Failure with Reduced Versus Preserved Ejection Fraction. J Am Coll Cardiol. 2018;72(10):1081-1090. https://doi.org/10.1016/j.jacc.2018.06.050
35. Lakhani I, Wong MV, Hung JKF, Gong M, Waleed KB, et al. Diagnostic and prognostic value of serum C-reactive protein in heart failure with preserved ejection fraction: a systematic review and meta-analysis. Heart Fail Rev. 2021;26(5):1141-1150. https://doi.org/10.1007/s10741-020-09927-x
36. Izumiya Y, Hanatani S, Kimura Y, Takashio S, Yamamoto E, et al. Growth differentiation factor-15 is a useful prognostic marker in patients with heart failure with preserved ejection fraction. Can J Cardiol. 2014;30(3):338-344. https://doi.org/10.1016/j.cjca.2013.12.010
37. Yin D, Yan X, Bai X, Tian A, Gao Y, Li J. Prognostic value of Growth differentiation factors 15 in Acute heart failure patients with preserved ejection fraction. ESC Heart Fail. 2023;10(2):1025-1034. https://doi.org/10.1002/ehf2.14271
38. Kleber ME, Koller L, Goliasch G, Sulzgruber P, Scharnagl H, et al. Von willebrand factor improves risk prediction in addition to N-terminal pro-B-type natriuretic peptide in patients referred to coronary angiography and signs and symptoms of heart failure and preserved ejection fraction. Circ Heart Fail. 2015;8(1):25-32. https://doi.org/10.1161/CIRCHEARTFAILURE.114.001478
39. Naghipour S, Cox AJ, Peart JN, Du Toit EF, Headrick JP. Trimethylamine N-oxide: heart of the microbiota-CVD nexus? Nutr Res Rev. 2021;34(1):125-146. https://doi.org/10.1017/S0954422420000177
40. Dong Z, Zheng S, Shen Z, Luo Y, Hai X. Trimethylamine NOxide is Associated with Heart Failure Risk in Patients with Preserved Ejection Fraction. Lab Med. 2021;52(4):346-351. https://doi.org/10.1093/labmed/lmaa075
41. Salzano A, Israr MZ, Yazaki Y, Heaney LM, Kanagala P, et al. Combined use of trimethylamine N-oxide with BNP for risk stratification in heart failure with preserved ejection fraction: findings from the DIAMONDHFpEF study. Eur J Prev Cardiol. 2020;27(19):2159-2162. https://doi.org/10.1177/2047487319870355
42. Schuett K, Kleber ME, Scharnagl H, Lorkowski S, März w, et al. Trimethylamine-N-oxide and Heart Failure with Reduced Versus Preserved Ejection Fraction. J Am Coll Cardiol. 2017;70(25):3202-3204. https://doi.org/10.1016/j.jacc.2017.10.064
43. Salzano A, Israr MZ, Yazaki Y, Heaney LM, Kanagala P, et al. Combined use of trimethylamine N-oxide with BNP for risk stratification in heart failure with preserved ejection fraction: findings from the DIAMONDHFpEF study. Eur J Prev Cardiol. 2020;27(19):2159-2162. https://doi.org/10.1177/2047487319870355
44. Kinugasa Y, Nakamura K, Kamitani H, Hirai M, Yanagihara K, et al. Trimethylamine N-oxide and outcomes in patients hospitalized with acute heart failure and preserved ejection fraction. ESC Heart Fail. 2021;8(3):2103-2110. https://doi.org/10.1002/ehf2.13290
45. Abdelaziz Mohamed I, Gadeau AP, Hasan A, Abdulrahman N, Mraiche F. Osteopontin: A Promising Therapeutic Target in Cardiac Fibrosis. Cells. 2019;8(12):1558. https://doi.org/10.3390/cells8121558
46. Rosenberg M, Zugck C, Nelles M, juenger C, Frank D, et al. Osteopontin, a new prognostic biomarker in patients with chronic heart failure. Circ Heart Fail. 2008;1(1):43-49. https://doi.org/10.1161/CIRCHEARTFAILURE.107.746172
47. Yu L, Ruifrok WP, Meissner M, Bos EM, van Goor H, et al. Genetic and pharmacological inhibition of galectin-3 prevents cardiac remodeling by interfering with myocardial fi-brogenesis. Circ Heart Fail. 2013;6(1):107-117. https://doi.org/10.1161/CIRCHEARTFAILURE.112.971168
48. Wu CK, Su MY, Lee JK, Chiang FT, Hwang JJ, et al. Galectin-3 level and the severity of cardiac diastolic dysfunction using cellular and animal models and clinical indices. Sci Rep. 2015;5:17007. https://doi.org/10.1038/srep17007
49. van Kimmenade RR, januzzi JL Jr, Ellinor PT, Sharma UC, Bakker jA, et al. Utility of amino-terminal pro-brain natriuretic peptide, galectin-3, and apelin for the evaluation of patients with acute heart failure. J Am Coll Cardiol. 2006;48(6):1217-1224. https://doi.org/10.1016/j.jacc.2006.03.061
50. Shah RV, Chen-Tournoux AA, Picard MH, van Kimmenade RR, Januzzi JL. Galectin-3, cardiac structure and function, and long-term mortality in patients with acutely decompensated heart failure. Eur J Heart Fail. 2010;12(8):826-832. https://doi.org/10.1093/eurjhf/hfq091
51. Vianello E, Dozio E, Tacchini L, Frati L, Corsi Romanelli MM. ST2/IL-33 signaling in cardiac fibrosis. Int J Biochem Cell Biol. 2019;116:105619. https://doi.org/10.1016/j.biocel.2019.105619
52. O'Meara E, Prescott MF, Claggett B, Rouleau JL, Chiang LM, et al. Independent Prognostic Value of Serum Soluble ST2 Measurements in Patients with Heart Failure and a Reduced Ejection Fraction in the PARADIGM-HF Trial (Prospective Comparison of ARNI with ACEI to Determine Impact on Global Mortality and Morbidity in Heart Failure). Circ Heart Fail. 2018;11(5):e004446. https://doi.org/10.1161/CIRCHEARTFAILURE.117.004446
53. Shah KB, Kop WJ, Christenson RH, Diercks DB, Henderson S, et al. Prognostic utility of ST2 in patients with acute dyspnea and preserved leſt ventricular ejection fraction. Clin Chem. 2011;57(6):874-882. https://doi.org/10.1373/clinchem.2010.159277
54. Zile MR, Baicu CF, Gaasch WH. Diastolic heart failure--abnormalities in active relaxation and passive stiffness of the leſt ventricle. N Engl J Med. 2004;350(19):1953-1959. https://doi.org/10.1056/NEjMoa032566
55. Adamson PB, Abraham WT, Bourge RC, Costanzo MR, Hasan A, et al. wireless pulmonary artery pressure monitoring guides management to reduce decompensation in heart failure with preserved ejection fraction. Circ Heart Fail. 2014;7(6):935-944. https://doi.org/10.1161/CIRCHEARTFAILURE.113.001229
56. Dorfs S, Zeh W, Hochholzer W, Jander N, Kienzle RP, et al. Pulmonary capillary wedge pressure during exercise and long-term mortality in patients with suspected heart failure with preserved ejection fraction. Eur Heart J. 2014;35(44):3103-3112. https://doi.org/10.1093/eurheartj/ehu315
57. Borlaug BA, Nishimura RA, Sorajja P, Lam CS, Redfield MM. Exercise hemodynamics enhance diagnosis of early heart failure with preserved ejection fraction. Circ Heart Fail. 2010;3(5):588-595. https://doi.org/10.1161/CIRCHEARTFAILURE.109.930701
58. Obokata M, Kane GC, Reddy YN, Olson TP, Melenovsky V, Borlaug BA. Role of Diastolic Stress Testing in the Evaluation for Heart Failure with Preserved Ejection Fraction: A Simultaneous Invasive-Echocardiographic Study. Circulation. 2017;135(9):825-838. https://doi.org/10.1161/CIRCULATIONAHA.116.024822
59. Pieske B, Tschöpe C, de Boer RA, Fraser AG, Anker SD, et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur Heart J. 2019;40(40):3297-3317. Erratum in: Eur Heart J. 2021;42(13):1274. https://doi.org/10.1093/eurheartj/ehz641
60. Holland DJ, Prasad SB, Marwick TH. Prognostic implications of leſt ventricular filling pressure with exercise. Circ Cardiovasc Imaging. 2010;3(2):149-156. https://doi.org/10.1161/CIRCIMAGING.109.908152
61. Shim CY, Kim SA, Choi D, Yang WI, Kim JM, et al. Clinical outcomes of exercise-induced pulmonary hypertension in subjects with preserved leſt ventricular ejection fraction: implication of an increase in leſt ventricular filling pressure during exercise. Heart. 2011;97(17):1417-1424. https://doi.org/10.1136/hrt.2010.220467
62. Borlaug BA, Kane GC, Melenovsky V, Olson TP. Abnormal right ventricular-pulmonary artery coupling with exercise in heart failure with preserved ejection fraction. Eur Heart J. 2016;37(43):3293-3302. https://doi.org/10.1093/eurheartj/ehw241
63. Tan YT, Wenzelburger F, Lee E, Heatlie G, Leyva F, et al. The pathophysiology of heart failure with normal ejection fraction: exercise echocardiography reveals complex abnormalities of both systolic and diastolic ventricular function involving torsion, untwist, and longitudinal motion. J Am Coll Cardiol. 2009;54(1):36-46. https://doi.org/10.1016/j.jacc.2009.03.037
64. Kosmala w, Przewlocka-Kosmala M, Rojek A, Mysiak A, Dabrowski A, Marwick TH. Association of Abnormal Leſt Ventricular Functional Reserve with Outcome in Heart Failure with Preserved Ejection Fraction. JACC Cardiovasc Imaging. 2018;11(12):1737-1746. https://doi.org/10.1016/j.jcmg.2017.07.028
65. Borlaug BA. The pathophysiology of heart failure with preserved ejection fraction. Nat Rev Cardiol. 2014;11(9):507-515. https://doi.org/10.1038/nrcardio.2014.83
66. Ovchinnikov AG, Potekhina A, Belyavskiy E, Gvozdeva A, Ageev F. Leſt atrial dysfunction as the major driver of heart failure with preserved ejection fraction syndrome. J Clin Ultrasound. 2022;50(8):1073-1083. https://doi.org/10.1002/jcu.23318
67. Morris DA, Belyavskiy E, Aravind-Kumar R, Kropf M, Frydas A, et al. Potential Usefulness and Clinical Relevance of Adding Leſt Atrial Strain to Leſt Atrial Volume Index in the Detection of Leſt Ventricular Diastolic Dysfunction. JACC Cardiovasc Imaging. 2018;11(10):1405-1415. https://doi.org/10.1016/j.jcmg.2017.07.029
68. Obokata M, Reddy YNV, Borlaug BA. Diastolic Dysfunction and Heart Failure with Preserved Ejection Fraction: Understanding Mechanisms by Using Noninvasive Methods. JACC Cardiovasc Imaging. 2020;13(1 Pt 2):245-257. https://doi.org/10.1016/j.jcmg.2018.12.034
69. Santos AB, Roca Gq, Claggett B, Sweitzer NK, Shah SJ, et al. Prognostic Relevance of Leſt Atrial Dysfunction in Heart Failure with Preserved Ejection Fraction. Circ Heart Fail. 2016;9(4):e002763. https://doi.org/10.1161/CIRCHEARTFAILURE.115.002763
70. Guazzi M. Pulmonary hypertension in heart failure preserved ejection fraction: prevalence, pathophysiology, and clinical perspectives. Circ Heart Fail. 2014;7(2):367-377. https://doi.org/10.1161/CIRCHEARTFAILURE.113.000823
71. Hidalgo C, Granzier H. Tuning the molecular giant titin through phosphorylation: role in health and disease. Trends Cardiovasc Med. 2013;23(5):165-171. https://doi.org/10.1016/j.tcm.2012.10.005
72. Kosmala W, Jellis CL, Marwick TH. Exercise limitation associated with asymptomatic leſt ventricular impairment: analogy with stage B heart failure. J Am Coll Cardiol. 2015;65(3):257-266. https://doi.org/10.1016/j.jacc.2014.10.044
73. Lam CS, Roger VL, Rodeheffer RJ, Borlaug BA, Enders FT, Redfield MM. Pulmonary hypertension in heart failure with preserved ejection fraction: a community-based study. J Am Coll Cardiol. 2009;53(13):1119-1126. https://doi.org/10.1016/j.jacc.2008.11.051
74. Mohammed SF, Hussain I, AbouEzzeddine OF, Takahama H, Kwon SH, et al. Right ventricular function in heart failure with preserved ejection fraction: a community-based study. Circulation. 2014;130(25):2310-2320. Erratum in: Circulation. 2015;131(17):e424. doi: 10.1161/CIR.0000000000000202. Abou Ezzeddine, Omar F [corrected to AbouEzzeddine, Omar F]. https://doi.org/10.1161/CIRCULATIONAHA.113.008461
75. Ovchinnikov A, Potekhina A, Belyavskiy E, Ageev F. Heart Failure with Preserved Ejection Fraction and Pulmonary Hypertension: Focus on Phosphodiesterase Inhibitors. Pharmaceuticals (Basel). 2022;15(8):1024. https://doi.org/10.3390/ph15081024
76. Huang W, Oliveira RKF, Lei H, Systrom DM, Waxman AB. Pulmonary Vascular Resistance During Exercise Predicts Long-Term Outcomes in Heart Failure with Preserved Ejection Fraction. J Card Fail. 2018;24(3):169-176. https://doi.org/10.1016/j.cardfail.2017.11.003
77. Gorter TM, Hoendermis ES, van Veldhuisen Dj, Voors AA, Lam CS, et al. Right ventricular dysfunction in heart failure with preserved ejection fraction: a systematic review and meta-analysis. Eur J Heart Fail. 2016;18(12):1472-1487. https://doi.org/10.1002/ejhf.630
78. Melenovsky V, Hwang Sj, Lin G, Redfield MM, Borlaug BA. Right heart dysfunction in heart failure with preserved ejection fraction. Eur Heart J. 2014;35(48):3452-3462. https://doi.org/10.1093/eurheartj/ehu193
79. Guazzi M, Bandera F, Pelissero G, Castelvecchio S, Menicanti L, et al. Tricuspid annular plane systolic excursion and pulmonary arterial systolic pressure relationship in heart failure: an index of right ventricular contractile function and prognosis. Am J Physiol Heart Circ Physiol. 2013;305(9):H1373-81. https://doi.org/10.1152/ajpheart.00157.2013
80. Burke MA, Katz DH, Beussink L, Selvaraj S, Gupta DK, et al. Prognostic importance of pathophysiologic markers in patients with heart failure and preserved ejection fraction. Circ Heart Fail. 2014;7(2):288-299. https://doi.org/10.1161/CIRCHEARTFAILURE.113.000854
81. Ovchinnikov A, Filatova A, Sobolevskaya M, Potekhina A, Svirida O, et al. The prognostic role of cardiac hemodynamic reserves in heart failure with preserved ejection fraction. Journal of Hypertension. 2024;42(Suppl 1):p e242. https://doi.org/10.1097/01.hjh.0001021964.41256.b4
Об авторах
М. С. СоболевскаяРоссия
Соболевская Мария Сергеевна, лаборант-исследователь отдела амбулаторных лечебно-диагностических технологий Института Клинической Кардиологии им. А.Л. Мясникова
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
А. Д. Гвоздева
Россия
Гвоздева Анна Дмитриевна, к.м.н. врач функциональной диагностики
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
О. Н. Свирида
Россия
Свирида Ольга Николаевна, к.м.н., младший научный сотрудник лаборатории фиброза миокарда и сердечной недостаточности с сохранённой фракцией выброса Института Клинической Кардиологии им. А.Л. Мясникова, научный сотрудник отдела амбулаторных лечебно-диагностических технологий Института Клинической Кардиологии им. А.Л. Мясникова
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
А. Ю. Филатова
Россия
Филатова Анастасия Юрьевна, к.м.н., научный сотрудник лаборатории фиброза миокарда и сердечной недостаточности с сохранённой фракцией выброса Института Клинической Кардиологии им. А.Л. Мясникова, научный сотрудник лаборатории клеточной иммунологии Института Экспериментальной Кардиологии им. ак. В.Н. Смирнова
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Рецензия
Для цитирования:
Соболевская М.С., Гвоздева А.Д., Свирида О.Н., Филатова А.Ю. Предикторы неблагоприятного течения и прогноза у пациентов с сердечной недостаточностью с сохраненной фракцией выброса левого желудочка. Медицинский вестник Юга России. 2024;15(4):38-48. https://doi.org/10.21886/2219-8075-2024-15-4-38-48
For citation:
Sobolevskaya M.S., Gvozdeva A.D., Svirida O.N., Filatova A.Y. Predictors of unfavorable progression and prognosis in patients with heart failure with preserved left ventricular ejection fraction. Medical Herald of the South of Russia. 2024;15(4):38-48. (In Russ.) https://doi.org/10.21886/2219-8075-2024-15-4-38-48







































