Перейти к:
Предикторы неблагоприятных неврологических исходов у недоношенных детей: современный взгляд на проблему
https://doi.org/10.21886/2219-8075-2024-15-3-77-82
Аннотация
Цель: оценить прогностическую значимость антител к NR2-субъединице N-метил-D-аспартат (NMDA) рецептора глутамата и мозгового натрийуретического пропептида (NTproBNP) как предикторов неблагоприятных неврологических исходов у недоношенных детей.
Материалы и методы: в проспективное когортное сплошное исследование включён 151 недоношенный ребенок с гестационным возрастом (ГВ) 26–32 недели и массой тела 590–1990 г. Детям проводилось количественное определение уровня NTproBNP в пуповинной крови и уровень антител к NR2- субъединице NMDA рецептора глутамата в сыворотке крови на 21-е сутки жизни. Распределение детей по группам проводилось на основании оценки неврологических исходов в контрольных точках исследования: 1-я контрольная точка — момент выписки из стационара, 2-я контрольная точка — скоррегированный возраст (СКВ) 1 год жизни, 3-я контрольная точка — 4 года жизни.
Результаты: установлено «каскадное» увеличение когорты детей с неблагоприятными неврологическими исходами с 36,4% на момент выписки из стационара до 70% к 4-летнему возрасту. Установлены высокие значения уровня NT-proBNP в пуповинной крови и антител к NR2-субъединице NMDA рецептора глутамата на 21-е сутки постнатальной жизни у детей как с макроструктурными поражениями головного мозга в неонатальном периоде, так имеющих неблагоприятный неврологический исход в 1 год СКВ и в 4 года жизни.
Заключение: современные нейрохимические маркеры поражения ЦНС NT-proBNP и антитела к NR2-субъединице NMDA рецептора глутамата открывают возможности ранней диагностики повреждения головного мозга на клеточном уровне и начала нейропротективной терапии с целью снижения неврологической инвалидизации.
Ключевые слова
Для цитирования:
Павлинова Е.Б., Савченко О.А. Предикторы неблагоприятных неврологических исходов у недоношенных детей: современный взгляд на проблему. Медицинский вестник Юга России. 2024;15(3):77-82. https://doi.org/10.21886/2219-8075-2024-15-3-77-82
For citation:
Pavlinova E.B., Savchenko O.A. Predictors of unfavorable neurological outcomes in premature children: a modern view on the problem. Medical Herald of the South of Russia. 2024;15(3):77-82. (In Russ.) https://doi.org/10.21886/2219-8075-2024-15-3-77-82
Введение
Процент преждевременных родов во всем мире остается высоким без тенденции к снижению. В настоящее время сопряжённость недоношенности с нарушениями когнитивной функции и психического здоровья у детей становится очевидной. Особую озабоченность вызывает неврологический дефицит в отдаленном периоде у детей, рождённых преждевременно без макроструктурных поражений головного мозга. [1]
До недавнего времени поиск причин неврологического дефицита у данной категории детей лежал в плоскости патологических состояний перинатального периода [2] В настоящее время фокус внимания смещен на поиск микроструктурных и биохимических нарушений ЦНС, а также на изучение особенностей нейроонтогенеза у данной категории детей. [3] Ранняя диагностика микроструктурных нарушений головного мозга современными методами нейровизуализации порой недоступна и остается спорной из-за субъективности и методологических недостатков [4].
Приоритетным на сегодняшний момент является поиск биомаркеров повреждения головного мозга на клеточном уровне.
Цель исследования — оценить прогностическую значимость: антител к NR2-субъединице N-метил-D-аспартат (NMDA) рецептора глутамата и мозгового натрийуретического пропептида (N-terminal pro-BNP) как предикторов неблагоприятных неврологических исходов у недоношенных детей.
Материалы и методы
В проспективное когортное сплошное исследование включён 151 недоношенный новорождённый. Дети родились и получали лечение в Бюджетном учреждении здравоохранения Омской области «Городской клинический перинатальный центр» (г. Омск). Работа одобрена локальным этическим комитетом ФГБОУ ВО ОмГМУ Минздрава России (протокол №118 от 12.03.2020).
Критерии включения в исследование: недоношенные дети с гестационным возрастом (ГВ) 26–32 недели и массой тела при рождении 590–1990 г.
Критерии исключения: недоношенные дети с врождёнными пороками сердца (кроме случаев нарушения адаптации гемодинамики, характерных для недоношенных детей, — открытого артериального протока и открытого овального окна), врождёнными пороками развития головного мозга по данным методов нейровизуализации, дети с генетическими заболеваниями, отсутствие информированного добровольного согласия законных представителей ребенка на участие в исследовании.
Детям, включённым в исследование, методом иммуноферментного анализа проводилось количественное определение уровня мозгового натрийуретического пропептида (Nterminal probrain natriuretic peptide/NTproBNP) в пуповинной крови при рождении.
К концу 1-х суток жизни проводили нейросонографию головного мозга с определением кровотока и допплерэхокардиографию (допплерЭхоКГ) (для исключения из исследования детей с ВПР головного мозга и ВПС). На 21-е сутки жизни в сыворотке крови определяли уровень NR2-АТ (нг/мл) методом иммуноферментного анализа по протоколу, разработанному DRD Diagnostic Reagents Devices Ltd (инновационный центр «Сколково»). За время пребывания в стационаре и на момент выписки проводилась серия НСГ исследований с определением кровотока, а также ЭЭГ и МРТ головного мозга.
Распределение детей по группам проводилось на основании оценки неврологических исходов у детей, рождёнными глубоко недоношенными, в следующих контрольных точках исследования. Момент выписки из стационара — 1-я контрольная точка: I группа — дети со структурными поражениями ЦНС, II группа — без структурных поражений ЦНС. Скоррегированный возраст — 1-й год жизни (2-я контрольная точка): III группа — неблагоприятный исход, IV группа — благоприятный исход. Возраст — 4 года жизни (3-я контрольная точка): V группа — неблагоприятный исход, IV группа — благоприятный исход. (рис. 1)
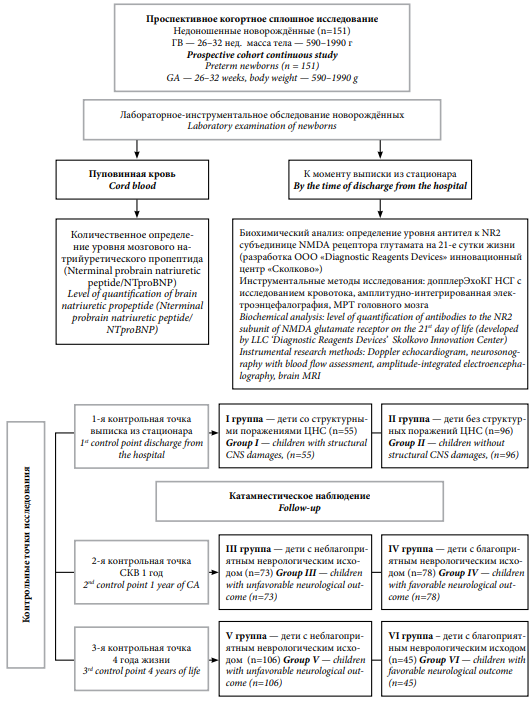
Рисунок 1. Дизайн клинического исследования
Figure 1. Clinical study design
Статистическая обработка полученной информации включала формирование базы данных с учётом клинической, лабораторной и морфофункциональной характеристик групп с использованием программы Microsoft Office. Excel-2003 для работы с электронными таблицами (лицензионное соглашение 74017-640-0000106-57177). Для статистической обработки материала использовался пакет прикладных программ Statistica v. 6.1 (лицензионное соглашение BXXR006B092218FAN11). Проверка статистических гипотез проводилась путём выявления различий в сравниваемых группах с применением теста Вальда-Вольфовица, U-критерия Манна-Уитни. При статистических расчётах критический уровень ошибки p считался равным 0,05. Сравнение групп по бинарному признаку, относительных частот внутри одной группы, в двух независимых группах проводилось путём построения четырёхпольных таблиц абсолютных частот, согласно проверке нулевой статистической гипотезы о равенстве относительных частот в двух популяциях с использованием точного двустороннего критерия Фишера, критерия χ2 с поправкой Йейтса.
Результаты
В 1-й контрольной точке исследования все дети были разделены на группы: I группа — недоношенные дети со структурными поражениями ЦНС (n=55), II группа — дети без структурных поражений ЦНС (n=96).
Дети исследуемых групп, не имели статистически значимых различий по массе тела при рождении (p = 0,156) и гестационному возрасту (p = 0,054): в I группе масса тела составила 1270,5 [ 990; 1490] г, ГВ — 30 [ 28; 32] недель, а во II группе — 1420 г [ 1125;1530] и 31 [ 29; 33] неделя соответственно. В результате исследования установлено, что дети I группы имели более высокие значения уровня лактата (p = 0,048), NTproBNP (р=0,0005) в пуповинной крови и уровень антител к NR2-субъединице NMDA-рецептора, определяемый на 21-е сутки жизни (p=0,00001) (табл. 1).
Таблица / Table 1
Значения биомаркеров повреждения ЦНС у недоношенных детей с благоприятными и неблагоприятными неврологическими исходами в различные возрастные периоды
Biomarker values of CNS damages in premature children with favorable and unfavorable neurological outcomes at various age periods
|
Контрольные точки
Control points
|
Исход
Outcome |
At к NR2 субъединице NMDA, 21-й день жизни, нг/мл
At to NR2 NMDA subunit 21st day of life, ng/mL
|
р |
NT –proBNP пуповинная кровь, пг/мл
NT –proBNP cord blood, pg/mL |
р |
Лактат пуповинной крови, ммоль/л.
Cord blood lactate, mmol/L |
р |
|
Выписка из стационара
Discharge from hospital
|
1 |
0,210 [ 0,120;0,343] 0,458 [ 0,247;2,563] |
0,0000.. |
631,6 [ 293,9;2136,6] |
0,0005* |
2,9 [ 1,9;3,9] |
0,048* |
|
2 |
0,180 [ 0,130;0,299] 0,209 [ 0,139;0,331] |
251,0 [ 83,5;391,9] |
2,0 [ 1,5;3,0] |
||||
|
скоррегированный возраст (СКВ) 1 год corrected age 1 year |
1 |
0,247 [ 0,128;0,435] 0,325 [ 0,213;1,301] |
0,001* |
804,0 [ 323,2;2397,7] |
0,009* |
2,8 [ 1,7;3,8] |
0,041* |
|
2 |
0,146 [ 0,09;0,247] 0,200 [ 0,120;0,266] |
207,1 [ 67,7;345,6] |
2,2 [ 1,4;2,7] |
||||
|
4 года жизни
4 years of life |
1 |
0,247 [ 0,119;0,367] |
0,03* |
801,3 [ 273,1;2136,6] |
0,0004* |
2,2 [ 1,5;3,1] |
0,579 |
|
2 |
0,1467 [ 0,070; 0,174] |
128,9 [ 58,6;333,1] |
2,0 [ 1,4;3,1] |
Примечание: *различия между группами статистически значимы (p<0,05); сравнение двух независимых групп критерием Манна-Уитни. Исход 1 — неблагоприятный. Исход 2 — благоприятный.
Note: * differences between groups are statistically significant (p < 0.05); comparison of two independent groups by the Mann-Whitney criterion. Outcome 1 — unfavorable. Outcome 2 — favorable.
К моменту выписки из стационара 55 детей (36,4 %) имели cтруктурное поражение головного мозга: внутрижелудочковое излияние (ВЖК) 1–2 ст. (25,5%), перивентрикулярная лейкомаляция (ПВЛ) (10,9%), вентрикулодилатацию (30,9%), поражение мозга, характерное для внутриутробной инфекции (ВУИ) (9%), ВЖК 2–3 ст. с ПВЛ (11%) и мультикистозное поражение вещества головного мозга (3,6%), паренхиматозное кровоизлияние (5,4%), ишемический инсульт (3,6%).
Во 2-й контрольной точке исследования (1 год скоррегированный возраст (СКВ)) по неврологическим исходам дети были разделены на группы: III группа — неблагоприятный (n=73) и IV группа — благоприятный (n=78). Дети данных групп не имели статистически значимых различий по массе тела при рождении (p = 0,578) и гестационному возрасту (p = 0,864): в III группе масса тела составила 1100 [ 858; 1490] г, ГВ — 30 [ 28; 32] недель, а в IV группе — 1200 г [ 990;1350] и 31 [ 29; 30] неделя соответственно. Установлено, что дети III группы имели более высокие значения уровня лактата (p = 0,041), NTproBNP (р=0,009) в пуповинной крови и уровень антител к NR2-субъединице NMDA-рецептора на 21-е сутки жизни (p=0,001) (табл. 1).
К 1-му году СКВ когорта детей с неврологическими нарушениями увеличилась на 18 детей и составила 73 ребенка (48 %). В данной когорте детей нейросенсорная тугоухость диагностирована у 1 ребенка (1,4%), эпилепсия — 2 детей (2,7%), ЗРР — 39 детей (53,5%), задержка моторного развития — 10 детей (13,6%), задержка ПМР — 20 детей (27,4%), ДЦП у — 1 ребенка (1,4%).
На этапе 3-й контрольной точки (4 года жизни) по неврологическим исходам дети были разделены на группы: V группа — неблагоприятный (n=106), VI группа — благоприятный (n=45). Дети исследуемых групп не имели статистически значимых различий по массе тела при рождении (p = 0,617) и гестационному возрасту (p = 0,564): в V группе масса тела составила 1285 [ 950; 1500] г, ГВ — 30 [ 28; 32] недель, а в VI группе — 1200 г [ 980;1350] и 30 [ 29; 32] недель соответственно. В результате исследования установлено, что дети V группы имели более высокие значения NTproBNP (р=0,0004) и уровень антител к NR2-субъединице NMDA-рецептора на 21-е сутки жизни (p=0,03) (табл. 1).
К 4-летнему возрасту когорта детей с неврологическими нарушениями увеличилась на 33 ребенка (22%) и составила 70% (106 детей). Структура неврологической патологии к 4 годам жизни: РАС — у 8 детей (8%), ЗРР (сенсорная, моторная, смешенная алалия) — 65 детей (61,3%), общая интеллектуальная недостаточность — 20 детей (22%), эпилепсия — 6 детей (5,7%), ДЦП — 3 человека (2,8%).
Обсуждение
Недоношенность остается ведущей причиной детской неврологической заболеваемости и инвалидности. У данной категории детей отмечается снижение коэффициента интеллекта, социальной адаптации, высокая частота психических расстройств [5].
Особую озабоченность вызывают отдаленные неблагоприятные неврологические исходы у недоношенных детей без макроструктурных изменений головного мозга в перинатальном периоде.
По результатам нашего исследования выявлено «каскадное» увеличение когорты детей с неблагоприятными неврологическими исходами с момента выписки из стационара к 4-летнему возрасту: к моменту выписки из стационара 55 детей (36,4 %) имели cтруктурные поражения головного мозга; к 1-му году жизни когорта с неблагоприятными исходами в виде двигательных, когнитивных и поведенческих нарушений увеличилась на 18 детей и составила 73 ребенка (48 %), а к 4-летнему возрасту — неблагоприятные неврологические исходы отмечались у 106 детей (70%).
Таким образом, из 96 недоношенных детей, выписанных из стационара без структурных поражений головного мозга, к 4-летнему возрасту лишь 45 детей (30%) не имели неврологических нарушений. Лидирующие позиции в структуре неврологической патологии занимали расстройства аутистического спектра (РАС) (8%), задержка речевого развития (ЗРР) (61,3%), общая интеллектуальная недостаточность (22%).
Диагностика нейронального повреждения детализирующими методами нейровизуализации (МРТ-морфометрия, инфракрасная спектроскопия мозга, трактография, функциональная МРТ) не всегда возможна, поэтому на современном этапе важен поиск биохимических маркеров повреждения ЦНС на клеточном уровне [6].
В настоящее время атипичное течение процессов нейроонтогенеза у недоношенных детей, результатом которого является уменьшение объёмов областей мозга, ставит под сомнение феномен «догоняющего» структурного роста головного мозга у детей, их нейрокогнитивное и поведенческое развитие в будущем [7].
Ранним предиктором течения данного процесса рассматривается натрийуретическая пептидная система, которая со II триместра внутриутробного развития регулирует не только фетально-плацентарный кровоток, но также участвует в нейроонтогенезе. Не регулируя активность нейронов напрямую, она модулирует их работу через рецепторы, экспрессируемые в глии и выступает как нейротрансмиттер [8].
В лимбической системе и коре головного мозга широко представлены рецепторы N-концевого предшественника мозгового натрийуретического пептида (NT-proBNP), высокий уровень которого прямо коррелирует с малым объёмом серого вещества головного мозга и низким когнитивным уровнем людей во всех возрастных группах [9]. Известно, что NT-proBNP участвует в регуляции целостности нейроваскулярного и гематоэнцефалического барьера, синаптической передаче и нейровоспалении на уровне микроглии. [10] Установлена прямая корреляция уровня NT-proBNP с малым объёмом головного мозга, серого вещества и с аномальной микроструктурной организацией белого вещества. NT-proBNP рассматривается как предиктор субклинического повреждения головного мозга, эпилепсии, аутизма и аффективных расстройств [11].
Эксайтотоксичность — один из механизмов повреждения пре- и олигодендроцитов в развивающемся мозге, опосредуемый через популяцию глутаматергических ионотропных рецепторов N-метил-d-аспартата (NMDA). Чрезмерная стимуляция этих рецепторов при гипоксии приводит к посттравматическому окислительному стрессу и гибели клеток в течение длительного периода, что может определять отдалённый по времени неврологический дефицит у ребенка [12].
По результатам проведённого нами исследования, высокие значения уровня NT-proBNP в пуповинной крови и NR2-антител к NMDА-рецепторам на 21-е сутки постнатальной жизни установлены у детей, имеющих как макроструктурные поражения головного мозга в неонатальном периоде, так и неблагоприятный неврологический исход в 1-й год СКВ и в 4 года жизни. Уровень лактата пуповинной крови, как маркер степени тяжести внутриутробной гипоксии, утрачивает прогностическую значимость в оценке риска неблагоприятного неврологического исхода у детей к 4 годам жизни.
Заключение
Использование современных нейрохимических маркеров поражения ЦНС открывают возможности ранней диагностики повреждения головного мозга на клеточном уровне и начала нейропротективной терапии с целью снижения неврологической инвалидизации.
Список литературы
1. Finch-Edmondson M, Morgan C, Hunt RW, Novak I. Emergent Prophylactic, Reparative and Restorative Brain Interventions for Infants Born Preterm With Cerebral Palsy. Front Physiol. 2019;10:15. https://doi.org/10.3389/fphys.2019.00015
2. Penn AA, Gressens P, Fleiss B, Back SA, Gallo V. Controversies in preterm brain injury. Neurobiol Dis. 2016;92(Pt A):90-101. https://doi.org/10.1016/j.nbd.2015.10.01
3. Malik S, Vinukonda G, Vose LR, Diamond D, Bhimavarapu BB, et al. Neurogenesis continues in the third trimester of pregnancy and is suppressed by premature birth. J Neurosci. 2013;33(2):411-423. https://doi.org/10.1523/JNEUROSCI.4445-12.2013
4. Oltman SP, Rogers EE, Baer RJ, Jasper EA, Anderson JG, et al. Newborn metabolic vulnerability profile identifies preterm infants at risk for mortality and morbidity. Pediatr Res. 2021;89(6):1405-1413. https://doi.org/10.1038/s41390-020-01148-0
5. Weider S, Lærum AMW, Evensen KAI, Reitan SK, Lydersen S, et al. Neurocognitive function and associations with mental health in adults born preterm with very low birthweight or small for gestational age at term. Front Psychol. 2023;13:1078232. https://doi.org/10.3389/fpsyg.2022.1078232
6. Vo Van P, Alison M, Morel B, Beck J, Bednarek N, et al. Advanced Brain Imaging in Preterm Infants: A Narrative Review of Microstructural and Connectomic Disruption. Children (Basel). 2022;9(3):356. https://doi.org/10.3390/children9030356
7. Ma Q, Wang H, Rolls ET, Xiang S, Li J, et al. Lower gestational age is associated with lower cortical volume and cognitive and educational performance in adolescence. BMC Med. 2022;20(1):424. https://doi.org/10.1186/s12916-022-02627-3
8. Miyoshi T, Hosoda H, Minamino N. Significance of Atrial and Brain Natriuretic Peptide Measurements in Fetuses With Heart Failure. Front Physiol. 2021;12:654356. https://doi.org/10.3389/fphys.2021.654356
9. Abdelalim EM, Takada T, Torii R, Tooyama I. Molecular cloning of BNP from heart and its immunohistochemical localization in the hypothalamus of monkey. Peptides. 2006;27(7):1886-1893. https://doi.org/10.1016/j.peptides.2006.01.001
10. Gallo G, Bianchi F, Cotugno M, Volpe M, Rubattu S. Natriuretic Peptides, Cognitive Impairment and Dementia: An Intriguing Pathogenic Link with Implications in Hypertension. J Clin Med. 2020;9(7):2265. https://doi.org/10.3390/jcm9072265
11. Zonneveld HI, Ikram MA, Hofman A, Niessen WJ, van der Lugt A, et al. N-Terminal Pro-B-Type Natriuretic Peptide and Subclinical Brain Damage in the General Population. Radiology. 2017;283(1):205-214. https://doi.org/10.1148/radiol.2016160548
12. Савченко О.А., Павлинова Е.Б. Отдаленные неврологические исходы у недоношенных детей при эксайтотоксическом повреждении головного мозга. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2022;122(9-2):37-41. https://doi.org/10.17116/jnevro202212209237
Об авторах
Е. Б. ПавлиноваПавлинова Елена Борисовна, д.м.н., доцент, заведующая кафедрой госпитальной педиатрии с курсом ДПО, проректор по учебной работе
Омск
О. А. Савченко
Россия
Савченко Ольга Анатольевна, к.м.н., доцент кафедры госпитальной педиатрии с курсом ДПО
Омск
Рецензия
Для цитирования:
Павлинова Е.Б., Савченко О.А. Предикторы неблагоприятных неврологических исходов у недоношенных детей: современный взгляд на проблему. Медицинский вестник Юга России. 2024;15(3):77-82. https://doi.org/10.21886/2219-8075-2024-15-3-77-82
For citation:
Pavlinova E.B., Savchenko O.A. Predictors of unfavorable neurological outcomes in premature children: a modern view on the problem. Medical Herald of the South of Russia. 2024;15(3):77-82. (In Russ.) https://doi.org/10.21886/2219-8075-2024-15-3-77-82







































