Перейти к:
Роль морфо-функциональных асимметрий и сомнологического статуса в патогенезе гестационного сахарного диабета у женщин с избыточной массой тела
https://doi.org/10.21886/2219-8075-2023-14-2-26-35
Аннотация
Цель: выявление диабетогенного типа латерального поведенческого профиля асимметрий, при котором выявляется наибольшая частота развития ГСД и акушерских осложнений у беременных с избыточной массой, и на его основе исследовать особенности сомнологического статуса у женщин с диабетогенной латеральной конституцией на прегравидарном этапе.
Материалы и методы: в исследовании использовано специальное тестирование (тест Аннет, анкета качеств сна, анкета синдрома «апноэ / гипопноэ сна», шкала сонливости (Epworth)), полисомнографическое исследование.
Результаты: на основании результатов анкетного опроса и полисомнографического исследования выявлены сомнологические расcтройства, выражающиеся в нарастании проявлений снижения эффективности и качества сна, утомляемости, ощутимой сонливости в бодрствовании, расстройствах дыхания во сне и других нарушений сна, что способствует повышению риска возникновения гестационного сахарного диабета, преимущественно у женщин с амбидекстральным латеральным фенотипом.
Заключение: выявленные нарушениях сна у женщин с избыточной массой тела в прегравидарном периоде являются, с одной стороны, результатом гормональных сдвигов на фоне уже имеющихся метаболических и вегетативных отклонений у женщин с избыточной массой тела, планирующих беременность, с другой стороны, выступают в виде «триггера» функциональных нарушений как при манифестации ГСД, так и при формировании акушерских осложнений из-за нарастающей гипоксемии в материнском организме на фоне синдрома «обструктивного апноэ сна», что способствует развитию дистресса плода.
Ключевые слова
Для цитирования:
Боташева Т.Л., Дериглазова О.И., Лебеденко Е.Ю., Железнякова Е.В., Заводнов О.П., Желтецкая В.Ю., Улькина А.А. Роль морфо-функциональных асимметрий и сомнологического статуса в патогенезе гестационного сахарного диабета у женщин с избыточной массой тела. Медицинский вестник Юга России. 2023;14(2):26-35. https://doi.org/10.21886/2219-8075-2023-14-2-26-35
For citation:
Botasheva T.L., Deriglazova O.I., Lebedenko E.Yu., Zheleznyakova E.V., Zavodnov O.P., Zheltetskaya V.Yu., Ulkina A.A. The role of morphofunctional complexes and somnological signs of the pathogenesis of gestational diabetes mellitus in overweight women. Medical Herald of the South of Russia. 2023;14(2):26-35. (In Russ.) https://doi.org/10.21886/2219-8075-2023-14-2-26-35
Введение
Неуклонный рост частоты возникновения гестационного сахарного диабета (ГСД) и сопряженной с ним акушерской патологии способствует увеличению числа исследований по изучению патогенетических механизмов их формирования, разработке новых подходов к профилактике, прогнозированию, диагностике и лечению [1–16].
Избыточная масса тела и ожирение признаны факторами риска возникновения ГСД, в связи с чем именно эта категория женщин уже на прегравидарном этапе представляет значительный исследовательский интерес для разработки упреждающих мероприятий [17][18][12][19][20].
Одной из весомых причин, обусловливающих формирование избыточной массы тела и ожирения при метаболическом синдроме у женщин, являются нарушения продолжительности и качества сна, которые отмечается у 72% женщин [21][22][6][23–25], равно как и избыточная масса тела при метаболическом синдроме способствует формированию или усилению уже имеющихся сомнологических нарушений. Доказано, что патологические изменения качества сна сопровождаются набором веса из-за повышения уровня грелина, синтезируемого в фундальном отделе желудка, который усиливает чувство голода путём активации клеток дугообразного ядра и лимбической допаминергической системы, а также способствует снижению уровня пептидов, вырабатывающихся в толстом кишечнике и ответственных за подавление моторики желудочно-кишечного тракта [26][27]. В свою очередь, хроническое недосыпание приводит к снижению продукции орексина, нейропептида, контролирующего процесс бодрствования, синтез которого регулируется лептином. Кроме того, при этом отмечается снижение выработки меланотропного гормона, что приводит к усилению анаболизма [1][28–31]. Расстройства сна, часто возникающие у женщин в гестационном периоде, являются значимым фактором, способным определить исход всей беременности [1, 6]. Наиболее грозным осложнением нарушений сна является синдром обструктивного апноэ сна, характеризующийся повторными моментами обструкции верхних дыхательных путей на протяжении времени сна, которые ассоциированы со снижением сатурации. Частота обструктивного апноэ сна у беременных с метаболическим синдромом в 1,8 раза выше, а при ожирении — в 2,6 раза выше, чем у беременных с нормальной массой тела [32–34].
Установлено, что на характер метаболических процессов в женском организме оказывают значительное влияние функциональные межполушарные асимметрии (ФМА): у беременных с метаболическим синдромом и избыточной массой тела отмечается преимущественная активация правополушарных обмен-ассоциированных структур головного мозга [3][4].
Морфо-функциональные асимметрии (МФА) женского организма являются одним из базовых конституциональных морфо-функциональных принципов организации живых организмов [35][3][36][12]. Значимость МФА в регуляции висцеральными, эндокринными и иммунными процессами определяется анатомической вовлечённостью медиальной префронтальной и инсулярной зоны коры через множество подкорковых образований переднего, промежуточного мозга и мозгового ствола, контролирующих преганглионарные симпатические и парасимпатические проводники. К ним относятся центарные ядра миндалины, серое вещество ствола мозга, ретикулярная медуллярная зона и центр вегетативной интеграции — гипоталамус. В последнее время появилось много убедительных экспериментальных и клинических данных, свидетельствующих об их латерализованной функциональной специализации, определяющей индивидуальные особенности вегетативной и метаболической регуляции функциональных процессов, в том числе и в женском организме [36–38, 12].
Данные литературы свидетельствуют о том, что МФА женского организма, а также репродуктивной системы, во многом определяют не только направленность программ функционального «поведения» различных звеньев системы «мать – плацента – плод» в зависимости от преобладания правополушарных или левополушарных афферентно-эфферентных регуляторных программ, но и характер акушерских осложнений [37][38][3][12]. При этом пространственная согласованность предгестационных и собственно гестационных процессов, каждый из которых детерминирован генетически, может быть реализован только в соответствии с индивидуальной латеральной конституцией (латеральным фенотипом), тестовым коррелятом которой является латеральный поведенческий профиль асимметрий (ЛППА) [36][38][39]. Имеются данные о том, что проявления биохимической асимметрии полушарий мозга характеризуются разным содержанием белков и нуклеиновых кислот, нейромедиаторов, количества и активности тропных им нейронных рецепторов, ферментов и даже микроэлементов, что имеет непосредственное отношение к регуляции обменных процессов [3][37][38]. Установлено, что сонаправленность и разнонаправленность исходных и формирующихся при наступлении беременности гестационных асимметрий в одних случаях опосредуют неосложнённое течение беременности, в других — формирование многочисленных акушерских осложнений [38]. Имеются данные о значении МФА в патогенезе сахарного диабета 2 типа (СД2) [3][6]. Однако исследований о влиянии межполушарных асимметрий на регуляцию обменных процессов и сомнологического статуса у женщин в прегравидарном периоде в доступной литературе не выявлено.
Цель исследования — установить тип латерального поведенческого профиля асимметрий, при котором выявляется наибольшая частота развития ГСД и акушерских осложнений у беременных с избыточной массой и на его основе исследовать особенности сомнологического статуса у женщин с диабетогенной латеральной конституцией на прегравидарном этапе.
Материалы и методы
Поскольку показатели ЛППА генетически детерминированы, не меняются в течение жизни, это послужило поводом выявить наиболее диабет-ассоциированный латеральный фенотип путем тестирования по Аннет группы беременных женщин, у которых уже наступила манифестация ГСД, что было необходимо для следующего этапа исследований по изучению сомнологического статуса у женщин группы риска в прегравидарном периоде с учетом типа ЛППА. Было проведено тестирование (тест Аннет) для определения типа ЛППА у 2458 беременных с индексом массы тела (ИМТ) 25–29 в сроки 16–23 недели гестации. После тестирования по Аннет каждому результату теста присваивался весовой коэффициент, на основании которого вычислялись средневзвешенные показатели: правши имели не менее 90% правых признаков по четырем уровням («глаза», «уши», «руки», «ноги»), левши — не менее 90% левых признаков. К амбидекстрам относили женщин, имевших не менее 60% правых и 40% левых признаков. Затем путем рандомизации с использованием программы EXELL пакета OFICE (функция «Случмежду») были отобраны 913 беременных, вошедших в «0» группу. Из них 386 — с правым ЛППА, 415 — с амби-ЛППА и 112 — с левым ЛППА, в которых определяли частоту обнаружения ГСД.
На этапе изучения особенностей сомнологического статуса были отобраны женщины, планировавшие первую беременность с избыточной массой тела (ИМТ 25–29) и диагнозом «метаболический синдром», установленным на основании одного главного и двух дополнительных критериев (индекса резистентности HOMA-IR ≥2,77, уровня глюкозы в плазме крови натощак ≥5,1 ммоль/л). Дополнительными критериями являлись уровень липопротеидов высокой плотности <1,2 ммоль/л, липопротеидов низкой плотности >3,0 ммоль/л, триглицеридов ≥1,7 ммоль/л, уровень экскреции альбумина с мочой >20 мкг/мин., артериальное давление 140/90 мм рт. ст., отношение окружности талии к окружности бедер >0,85. Были сформированы две клинические группы: I — основная (135 женщин с избыточной массой тела, ИМТ 25–29, амби-ЛППА) и II — контрольная (156 беременных с нормальными показателями веса, ИМТ 18–24, амби-ЛППА-А).
Для изучения сомнологического статуса женщин использовалась «Анкета балльной оценки субъективных характеристик сна» (модификация анкеты Шпигеля) (при показателе <19 баллов диагностировались нарушения сна). Нарушения дыхания во сне выявлялись при помощи «Анкеты для скрининга синдрома апноэ во сне» (показатель ³4 баллов свидетельствовал о нарушениях дыхания). Уровень дневной сонливости определяли при помощи шкалы сонливости Epworth (1990) (5–9 баллов свидетельствовали о выраженной дневной сонливости). Сомнографическое обследование женщин проводилось с помощью програмно-аппаратного комплекса «Энцефалан-ЭЭГР-19/26» в ночное время. Осуществляли регистрацию электроэнцефалограммы (ЭЭГ), электрокардиограммы (ЭКГ), электроокулограммы (ЭОГ), электромиограммы (ЭМГ) подъязычной мышцы, частоты дыхания (ЧД), пульсоксиметрии, актиграфии. ЭЭГ записывалась монополярно по системе 10/20 в симметричных лобных, височных, центральных, теменных и затылочных отведениях с постоянной времени 0,3 сек. Анализ ЭЭГ проводился на эпохах длительностью 20 с при определении частотно-амплитудных и спектральных характеристик методом быстрого преобразования Фурье и определением событий сна кластерным методом. Рассчитывался индекс выраженности частотных диапазонов ЭЭГ: дельта-активности (0,5–2 Гц), дельта 2-активности (2–4 Гц), тета-активности (4–8 Гц), альфа-активности (8–12 Гц), сигма-активности (12–18 Гц), бета-активности (18–36 Гц), а также локализация максимальной амплитуды ритмов ЭЭГ для каждой стадии сна. Характеристики ЭЭГ изучались в бодрствовании с закрытыми глазами до сна, во всех фазах сна и после пробуждения. Структура сна (фазы, циклы, стадии, гипнограммы) оценивалась при использовании показателей ЭЭГ, ЭМГ, ЭКГ и ЧД. Эффективность сна (ЭС) определялась в минутах по формуле: ЭС = (ДС+ДД)/(ЛС+ВБ), где: ДС — общая длительность сна, ДД — продолжительность дельта-сна, ЛПС — латентная величина наступления сна, ВБ — время бодрствования внутри ночи. Чем меньше была величина показателя ЭС, тем более продуктивным считался сон. Вместе с тем оценивали сегментарные показатели сна при расчёте числа сегментов (участков однородной глубины сна) в стадиях сна. Определялась доля сегментов в каждой стадии при общей продолжительности стадии 100%. Кроме того, определялись количество и продолжительность разных типов межсегментных эпизодов в стадиях сна.
Обработка данных осуществлялась с помощью процедур описательной статистики. При обработке данных оценивались значения М и m (при нормальном распределении данных), медианы и интерквартильного размаха (25%, 75%) (при неправильном распределении данных) Статистическая значимость результатов рассчитывалась при доверительной вероятности 95%. Для сравнения межгрупповых различий использовался непараметрический критерий Манна-Уитни (при уровне значимости 0,05), для сравнения трех зависимых групп при отсутствии нормального распределения применялся непараметрический метод Фридмена. Для выявленных статистически значимых различий проводится апостериорный анализ с помощью критерия Вилкоксона с поправкой Бонферрони. Также сравнивались относительные показатели (частоты, доли, проценты) между группами с помощью критерия хи-квадрат или точный критерий Фишера. Статистическая обработка данных велась с использованием пакетов прикладных программ Statistica версии 10.01, EXCEL 2010, IBM SPSS 24.0.
В соответствии с юридическими аспектами осуществления научных исследований все женщины подписывали информированное согласие на участие в исследованиях.
Результаты
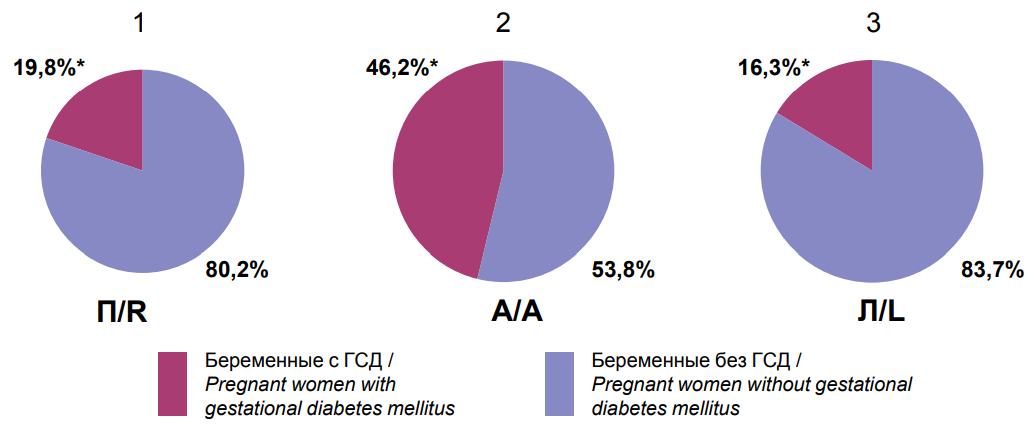
При определении частоты обнаружения ГСД («0» группа) в подгруппах с различным ЛППА было установлено, что наибольшее число случаев с ГСД регистрировалось у беременных с амбилатеральным латеральным поведенческим профилем асимметрий (192/415 (46,2%) по сравнению с 76/386 (19,8%) при правом ЛППА (р=0,0001) и 18/112 (16,3%) при левом ЛППА (р=0,001) (рис. 1).
|
Примечания: * — статистическая значимость отличий между клиническими группами; П — правый латеральный поведенческий профиль асимметрий; А — амбидекстральный латеральный поведенческий профиль асимметрий; Л — левый латеральный поведенческий профиль асимметрий. Notes: * — statistical significance of differences between clinical groups; R — right lateral behavioral profile of asymmetries; A — ambidextral lateral behavioral profile of asymmetries; L — left lateral behavioral profile of asymmetries. |
|
Рисунок 1. Частота обнаружения гестационного сахарного диабета у беременных с правым (1), амбилатеральным (2) и левым (3) типами латерального поведенческого профиля асимметрий. Figure 1. The frequency of detection of gestational diabetes mellitus in pregnant women with right (1), ambilateral (2) and left (3) types of lateral behavioral profile of asymmetries. |
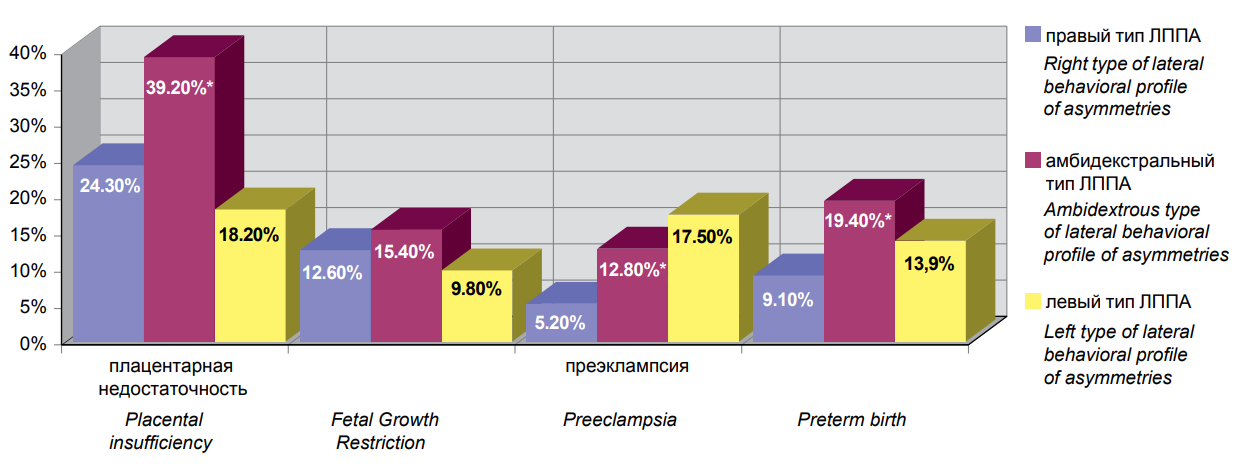
При анализе частоты обнаружения некоторых акушерских осложнений в подгруппах с различными типами ЛППА было установлено, что плацентарная недостаточность значимо чаще регистрировалась у беременных с амби-ЛППА (163/415 (39,2%) в сравнении с правым ЛППА 94/386 (24,3%) (р=0,001) и левым ЛППА (20/112) (18,2%) (р=0,001) (рис. 2).
 |
|||||
|
Примечание: * — статистическая значимость отличий между клиническими группами. Note: * — statistical significance of differences between clinical groups. Рисунок 2. Частота обнаружения некоторых видов акушерских осложнений у беременных с правым (1), амбилатеральным (2) и левым (3) типами латерального поведенческого профиля асимметрий. Figure 2. The frequency of detection of certain types of obstetric complications in pregnant women with right (1), ambilateral (2) and left (3) types of lateral behavioral profile of asymmetries. |
Статистически значимых различий в частоте обнаружения задержки роста плода в различных латеральных подгруппах не обнаружено: (амби-ЛППА 64/415 (15,4%) в сравнении с правым ЛППА (94/386 (12,6%) (р=0,25)) и левым ЛППА (11/112 (9,8%) (р=0,13)). Частота обнаружения случаев преэклампсии была значимо выше у женщин с амби-ЛППА (53/415 (12,8%) в сравнении с правым ЛППА (20/386 (5,2%) (р=0,002)). Значимых различий в группе беременных с левым ЛППА не выявлено ((20/112 (17,5) (р=0,21)). Преждевременные роды также значимо чаще выявлялись у беременных с амби-ЛППА 81/415 (19,4%), но лишь в равнении с правым ЛППА (35/386 (9,1%) (р=0,0001). Значимых различий в подгруппе с левым ЛППА не выявлено (16/112 (13,9%) (р=0,18)).
Таким образом, в результате латерального типирования беременных с избыточной массой тела был выявлен амбидекстральный (смешанный) латеральный профиль асимметрий, при котором регистрировалось наибольшая частота ГСД и некоторых акушерских осложнений. Именно этот фенотип послужил в дальнейшем для формирования выборки пациенток группы риска с избыточной массой тела с целью проведения сомнологических исследований непосредственно на прегравидарном этапе.
В процессе анализа анкетных данных при исследовании структуры сна обнаружено, что продолжительность сна у всех женщин находилась в диапазоне 7,1–7,7 часа. Женщины I клинической группы отмечали более выраженную утомляемость, снижение качества сна, сонливость в бодрствовании (табл. 1).
Таблица / Table 1
Показатели тестов для изучения особенностей сомнологического статуса у женщин с избыточной и нормальной массой тела при амби-латеральном поведенческом профиле асимметрий (прегравидарный период (М±m))
Indicators of tests for studying the features of somnological status in women with excess weight and normal body weight with an ambilateral behavioral profile of asymmetries (preconception period (M ± m))
|
Тесты для изучения сомнологического статуса Tests to study the immunological status |
Группы обследуемых женщин Groups of surveyed women |
P |
|
|
I группа (n=135) Group I (n=135) |
II группа (n=156) Group II (n=156) |
||
|
Анкета качества сна Sleep Quality Questionnaire |
17,1±2,1 |
24,5±1,9 |
0,04129 |
|
Анкета синдрома «апноэ/гипопноэ сна» Sleep apnea/hypopnea questionnaire |
7,9±1,8 |
2,0±1,3 |
0,0453 |
|
Шкала сонливости (Epworth) Sleepiness scale (Epworth) |
6,4±1,2 |
3,7±0,3 |
0,0306 |
Примечание: p<0,05 — статистически обоснованные различия между группами.
Note: p<0.05 — statistically valid differences between groups.
На основании более высоких показателей по шкале «апноэ сна» расстройства сна чаще наблюдались у женщин I группы.
При оценке полисомнографических показателей, отражающих объективную картину сна, к которым относятся характеристики кардио-респираторной системы, было установлено уменьшение частоты и амплитуды дыхания на фоне снижения ЧСС в медленноволновой фазе сна у женщин в I группе по сравнению с пациентками II группы. Кроме того, в фазе парадоксального сна и на первой и второй стадиях медленноволнового сна выявлены эпизоды повышенной вариабельности кардиоритма. Однако на второй и четвертой стадиях медленного сна у пациенток с избыточной массой тела регистрировались эпизоды относительной стабильности ЧСС.
Выявлены статистически значимые различия в максимальных и минимальных показателях частоты сердечных сокращений во сне у женщин I клинической группы, которые наряду с нарушениями дыхания во время сна неизбежно будут способствовать формированию акушерских осложнений уже на самых ранних этапах плодо-материнских отношений (табл. 2).
Таблица / Table 2
Особенности функциональной активности кардио-респираторной системы во время сна у женщин с избыточной и нормальной массой тела при амбилатеральном латеральном поведенческом профиле асимметрий (прегравидарный период) (Ме (Q1-Q3))
Features of the functional activity of the cardio-respiratory system during sleep in women with excess weight and normal body weight with an ambilateral lateral behavioral profile of asymmetries (preconception period) (Me (Q1-Q3))
|
Показатели кардиореспираторной системы женщин в процессе полисомнографического исследования Parameters of the cardiorespiratory system of women in the process of polysomnographic study |
I группа (n=135) Group I (n=135) |
II группа (n=156) Group II (n=156) |
р |
|
Средняя ЧСС в бодрствовании, уд./мин. Average heart rate in wakefulness, beats / min |
82,0 [ 76,1-87,3] |
75,2 [ 65,8-76,4] |
0,0531 |
|
Средняя ЧСС во сне, уд./мин. Average heart rate during sleep, bpm |
73,7 [ 68,3-79,1] |
65,1 [ 59,4-70,6] |
0,0632 |
|
Минимальная ЧСС, уд./мин. Minimum heart rate, bpm |
64,9 [ 59,3-84,6] |
50,2 [ 65,4-75,3] |
0,0458 |
|
Максимальная ЧСС, уд./мин. Maximum heart rate, bpm |
139,0 [ 97,0-138,5] |
92,3 [ 116,4-125,2] |
0,0315 |
|
Средняя ЧСС в поверх. cне (1st+2st), уд./мин. Average heart rate in superficial sleep (1st + 2st), bpm |
58,3 [ 52,7-69,8] |
64,9 [ 59,5-76,3] |
0,2371 |
|
Средняя ЧСС в дельта-сне (3st+4st), уд./мин. Average heart rate in delta sleep (3st + 4st), bpm |
67,2 [ 60,7-73,8] |
60,4 [ 58,2-69,9] |
0,2421 |
|
Средняя ЧСС в ПФС, уд/мин Average heart rate in Paradoxical sleep phase, bpm |
81,6 [ 75,3-87.4] |
72,2 [ 69,7-77,5] |
0,4257 |
|
Индекс апноэ Apnea index |
2,8 [ 0,9-3,5] |
0,7 [ 0,4-0,8] |
0,0444 |
|
Индекс апноэ/гипопноэ Apnea/hypopnea index |
10,6 [ 8,5-11,4] |
3,9 [ 1,6-4,3] |
0,0263 |
|
Минимальное насыщение крови кислородом, % Minimum blood oxygen saturation, % |
87,1 [ 86,4-89,7] |
95,6 [ 92,5-99,1] |
0,0252 |
|
Длительность десатураций, сек. Duration of desaturations, sec |
136,4 [ 108,2-144,8] |
30,1 [ 25,9-46,3] |
0,0069 |
|
Количество эпизодов храпа Number of episodes of snoring |
514,7 [ 349,1-583,5] |
85,6 [ 68,3-97,9] |
0,0072 |
Примечание: p<0,05 — статистически обоснованные различия между группами.
Note: p<0.05 — statistically valid differences between groups.
Показатели дыхания у женщин I клинической группы характеризовались значительным числом эпизодов храпа, индексов «апноэ/гипопноэ сна» числа и продолжительности периодов десатураций в течение сна, что указывало на наличие гипоксемии у женщин с избыточной массой тела. Формирование десатураций у женщин I клинической группы являлось прямым следствием нарушения дыхания по типу «обструктивного апноэ сна». На фоне этих процессов отмечается формирование нарушений структуры ночного сна с развитием депривации глубоких фаз сна, одной из основных причин которой являются дисфункциональные изменения гормонпродуцирующей функции у женщин с избыточной массой тела.
У женщин с избыточной массой тела отмечалось статистически значимое снижение ЧСС при поверхностном сне, свидетельствовавшее о преобладании влияний парасимпатического отдела вегетативной нервной системы.
При анализе структуры сна по данным полисомнографического ЭЭГ выявлено увеличение длительности первой и второй стадий сна при уменьшении общей продолжительности фаз медленного и быстрого сна на фоне снижения качества сна у женщин в I клинической группе.
Кроме этого, у женщин I клинической группы отмечалось снижение представленности фаз быстрого сна при увеличении длительности эпизодов бодрствования в течение ночи. Количество циклов сна у женщин основной и контрольной групп значимо не различалось и составило в среднем 5 циклов (p=0,07). Однако имелись различия в длительности циклов: у женщин I группы наиболее продолжительным был второй цикл (р=0,03), у женщин II группы — третий цикл (р=0,04). В процессе оценки соотношения фаз в циклах. При анализе соотношения фаз в циклах сна обнаружено, что у женщин I клинической группы во всех циклах сна преобладала медленноволновая фаза, однако выраженность медленоволновой фазы за счёт поверхностного сна в четвертом и пятом циклах была больше, а парадоксальной фазы — меньше, чем у пациенток контрольной группы. Пациенток II клинической группы в первых трёх циклах преобладала медленноволновая фаза, в то время как в четвертом и пятом циклах доминировала парадоксальная фаза, то есть в первых трёх циклах сна в медленноволновой фазе преобладали его глубокие стадии, в то время как в четвертом и пятом циклах сна — поверхностные стадии сна.
Для женщин с амби-ЛППА и избыточной массой тела были характерны наименьшие значения сегментации медленноволновой фазы сна и наибольшие — быстроволновой фаз сна по сравнению с женщинами, имевшими нормальные показатели массы тела, у которых регистрировались максимальные значения сегментации обеих фаз сна.
Обсуждение
Полученные результаты позволяют расширить представление о формировании метаболических нарушений у женщин, обусловливающих избыточную массу тела: по-видимому, именно более выраженная вовлеченность правополушарных обмен-ассоциированных структур головного мозга при смешанном (амбидекстральном) типе ЛППА в регуляторные процессы в женском организме определяет преобладание анаболических процессов и избыточный набор веса на прегравидарном этапе и большую частоту ГСД на собственно гравидарном этапе у женщин с данной латеральной конституцией. Аналогичные данные были получены Н.В. Палиевой (2018) [3], доказавшей в процессе исследования механизмов центральной регуляции обмена у беременных, что наибольшая частота метаболических нарушений регистрируется при амбилатеральной и левосторонней локализациях плаценты у женщин-правшей, что создаёт предпосылки для амбидекстрии в женском организме и в результате чего также отмечается активация правого обмен-ассоциированного полушария, способствующая значительному увеличению числа случаев метаболических «срывов», вплоть до развития ГСД, отмечается усиление активности стресс-либерирующих подсистем женского организма, увеличение активности симпатического отдела вегетативной нервной системы, потенцируется эндотелиальная дисфункция и развивается целый ряд акушерских осложнений.
Выявленный у беременных диабет-ассоциированный латеральный фенотип в процессе тестового типирования помог существенно сузить исследовательский спектр женщин группы риска (избыточная масса тела) по ГСД, поскольку в этой группе имеется категория женщин, у которых ГСД всё же не манифестируется, равно как и при нормальной массе тела имеются случаи ГСД.
Заключение
Полученные данные свидетельствуют о возможности выявления категории женщин с наибольшим риском по развитию ГСД у женщин с избыточной массой тела с использованием латерального типирования. Для этого ещё до наступления беременности необходимо при помощи нетрудоёмкого теста выявлять женщин с диабет-ассоциированным фенотипом (амби-ЛППА), у обладательниц которого в 2,7 раза чаще по сравнению с другими типами ЛППА развивается ГСД на последующих этапах уже наступившей беременности. Для понимания патогенетических механизмов формирования ГСД большое значение имеют полученные результаты о нарушениях сна у женщин с избыточной массой тела при амби-ЛППА на прегравидарном этапе, являющихся, с одной стороны, результатом гормональных сдвигов на фоне уже имеющихся метаболических и вегетативных отклонений у женщин, планирующих беременность, с другой стороны, выступающих в виде «триггера» функциональных нарушений как при манифестации ГСД, так и при формировании акушерских осложнений (плацентарная дисфункция, задержка роста плода, дистресс плода, преэклампсия и т. д.), обусловленных нарастающей гипоксемией в материнском организме на фоне синдрома «обструктивного апноэ сна», что неизбежно будет способствовать развитию дистресса плода и ухудшению показателей перинатальной заболеваемости и смертности.
В связи с полученными данными очевидна необходимость дальнейшей разработки способов коррекции сомнологических нарушений у женщин с избыточной массой тела на этапе планирования беременности с целью профилактики ГСД и связанных с ним сопутствующих акушерских осложнений.
Список литературы
1. Cахарный диабет и репродуктивная система женщины : руководство для врачей. Под ред. Э. К. Айламазяна. – М.: ГэОТАР-Медиа; 2017.
2. Айламазян Э. К., Евсюкова И. И., Ярмолинская М. И. Роль мелатонина в развитии гестационного сахарного диабета. Журнал акушерства и женских болезней. 2018; 67 (1): 85-91.
3. Палиева Н. В., Боташева Т. Л., Хлопонина А. В., Заводнов О. П., Железнякова Е. В., Ганиковская Ю. В. Влияние морфо-функциональных асимметрий системы "мать - плацента - плод" на метаболический гомеостаз при беременности. Вестник Адыгейского государственного университета. Серия 4: Естественно-математические и технические науки. 2018; (4): 63-70.
4. Боташева Т. Л., Палиева Н. В., Хлопонина А. В., Васильева В. В., Железнякова Е. В., и др. Пол плода в формировании гестационного сахарного диабета и эндотелиальной дисфункции. Акушерство и гинекология. 2020; (9): 56-64.
5. Оразмурадов А. А., Ахматова А. Н., Аракелян Г. А., Савенкова И. В., Минаева А. В. Ожирение и гестационное увеличение массы тела в развитии гестационного сахарного диабета и его осложнений. Акушерство и гинекология. Новости. Мнения. Обучение. 2020; 8 (3 (29)): 86-89.
6. Ожирение. Диабет. Беременность. Версии и контраверсии. Клинические практики. Перспективы. Под ред. В. Е. Радзинского, Т. Л. Боташевой, Г. А. Койташ. М.: ГэОТАР-Медиа; 2020.
7. Ходжаева З. С., Снеткова Н. В., Муминова К. Т., Горина К. А., Абрамова М. Е., Есаян Р. М. Особенности течения беременности у женщин с гестационным сахарным диабетом. Акушерство и гинекология. 2020; 7: 47-52.
8. Абрамова М. Е., Ходжаева З. С., Горина К. А., Муминова К. Т., Горюнов К. В., и др. Гестационный сахарный диабет: скрининг и диагностические критерии в ранние сроки беременности. Акушерство и гинекология. 2021; 5: 25-32.
9. Капустин Р. В., Коптеева Е. В., Алексеенкова Е. Н., Цыбук Е. М., Аржанова О. Н. Анализ факторов риска и структуры перинатальных потерь у беременных с сахарным диабетом. Доктор.Ру. 2021; 20 (6): 46-52.
10. Матейкович Е. А. Неблагоприятные исходы беременности и гестационный сахарный диабет: от исследования HAPO к современным данным. Акушерство и гинекология. 2021; 2: 13-20.
11. Денисов А. А., Башмакова Н. В., Третьякова Т. Б., Давыденко Н. Б. Патогенетические подходы в прогнозировании преэклампсии с позиции липидного обмена. Лечение и профилактика. 2022; 12 (2): 33-38.
12. Боташева Т. Л., Рымашевский А. Н., Фабрикант А. Д., Петров Ю. А., Палиева Н. В., и др. Особенности гликемического статуса, про- и контринсулярных факторов у беременных с гестационным сахарным диабетом в зависимости от половой принадлежности плода. Главный врач Юга России. 2022; 1 (82): 6-9.
13. Billionnet C., Mitanchez D., Weill A., Nizard J., Alla F., et al. Gestational diabetes and adverse perinatal outcomes from 716,152 births in France in 2012. Diabetologia. 2017; 60 (4): 636-644. doi: 10.1007/s00125-017-4206-6
14. Akkurt M. O., Turan O. M., Crimmins S., Harman C. R., Turan S. Increased fetal epicardial fat thickness: A novel ultrasound marker for altered fetal metabolism in diabetic pregnancies. J Clin Ultrasound. 2018; 46 (6): 397-402. doi: 10.1002/jcu.22602
15. Chu A. H. Y., Yuan W. L., Loy S. L., Soh S. E., Bernard J. Y., et al. Maternal height, gestational diabetes mellitus and pregnancy complications. Diabetes Res Clin Pract. 2021; 178: 108978. doi: 10.1016/j.diabres.2021.108978
16. Shi P., Liu A., Yin X. Association between gestational weight gain in women with gestational diabetes mellitus and adverse pregnancy outcomes: a retrospective cohort study. BMC Pregnancy Childbirth. 2021; 21 (1): 508. doi: 10.1186/s12884-021-03982-4
17. Тажетдинов Е. Х., Костин И. Н., Ли К. И., Аршинова О. В., Чепорева О. Н., и др. Перспективы раннего скрининга гестационного сахарного диабета. Акушерство и гинекология. Новости. Мнения. Обучение. 2020; 8 (3 (29)): 90-94.
18. Главнова О. Б., Шелыгин М. С., Салухова А. В. Гестационный сахарный диабет: профилактика репродуктивных потерь. Фарматека. 2021; 28 (4): 34-37.
19. Boriboonhirunsarn D. Second trimester weight gain > 7 kg increases the risk of gestational diabetes after normal first trimester screening. J Obstet Gynaecol Res. 2017; 43 (3): 462-467. doi: 10.1111/jog.13231
20. Phelan S., Jelalian E., Coustan D., Caughey A. B., Castorino K., et al. Protocol for a randomized controlled trial of pre-pregnancy lifestyle intervention to reduce recurrence of gestational diabetes: Gestational Diabetes Prevention/Prevención de la Diabetes Gestacional. Trials. 2021; 22 (1): 256. doi: 10.1186/s13063-021-05204-w
21. Ковальзон В. М., Долгих В. В. Регуляция цикла бодрствование–сон. Неврологический журнал. 2016; 21 (6): 316–322.
22. Сомнология и медицина сна. Национальное руководство памяти А. М. Вейна и Я. И. Левина. Под ред. Полуэктова М. Г. М.: «Медфорум»; 2016.
23. Бурчаков Д. И., Полуэктов М. Г., Кузнецова И. В. Современные возможности коррекции нарушений сна у беременных. Лечебное дело. 2022; 1: 57-65.
24. Stone P. R., Burgess W., McIntyre J., Gunn A. J., Lear C. A., et al. An investigation of fetal behavioural states during maternal sleep in healthy late gestation pregnancy: an observational study. J Physiol. 2017; 595 (24): 7441-7450. doi: 10.1113/JP275084
25. Saadati F., Sehhatiei Shafaei F., Mirghafourvand M. Sleep quality and its relationship with quality of life among high-risk pregnant women (gestational diabetes and hypertension). J Matern Fetal Neonatal Med. 2018; 31 (2): 150-157. doi: 10.1080/14767058.2016.1277704
26. Цветкова Е. С., Романцова Т. И., Полуэктов М. Г., Рунова Г. Е., Глинкина И. В., Фадеев В. В. Значение мелатонина в регуляции метаболизма, пищевого поведения, сна и перспективы его применения при экзогенноконституциональном ожирении. Ожирение и метаболизм. 2021; 18 (2): 112-124.
27. Kryger M. H., Roth T., Dement W. C., eds. Principles and Practice of Sleep Medicine, 6th ed. Philadelphia. Elsevier; 2017.
28. Мисникова И. В., Ковалева Ю. А. Сон и нарушения метаболизма. РМЖ. 2017; 22: 1641-1645.
29. Хабаров С. В., Стерликова Н. А. Мелатонин и его роль в циркадной регуляции репродуктивной функции (обзор литературы). Вестник новых медицинских технологий. 2022; 29 (3): 17-31.
30. Ding F., O'Donnell J., Xu Q., Kang N., Goldman N., Nedergaard M. Changes in the composition of brain interstitial ions control the sleep-wake cycle. Science. 2016; 352 (6285): 550-5. doi: 10.1126/science.aad4821
31. Román-Gálvez R. M., Amezcua-Prieto C., Salcedo-Bellido I., Martínez-Galiano J. M., Khan K. S., Bueno-Cavanillas A. Factors associated with insomnia in pregnancy: A prospective Cohort Study. Eur J Obstet Gynecol Reprod Biol. 2018; 221: 70-75. doi: 10.1016/j.ejogrb.2017.12.007
32. Голоков В. А., Шнайдер Н. А., Николаева Т. Я., Голокова Е. А., Москалева П. В., Насырова Р. Ф. Нарушение сна и беременность (анализ литературы). Вестник Северо-Восточного федерального университета им. М. К. Аммосова. Серия: Медицинские науки. 2019; 2 (15): 81-93.
33. Мадаева И. М., Протопопова Н. В., Сахьянова Н. Л., Бердина О. Н., Семенова Н. В., и др Синдром обструктивного апноэ сна, беременность и состояние плода. Журнал неврологии и психиатрии им. С. С. Корсакова. Спецвыпуски. 2021; 121 (4- 2): 103- 109.
34. Bublitz M. H., Monteiro J. F., Caraganis A., Martin S., Parker J., et al. Obstructive Sleep Apnea in Gestational Diabetes: A Pilot Study of the Role of the Hypothalamic-Pituitary-Adrenal Axis. J Clin Sleep Med. 2018; 14 (1): 87-93. doi: 10.5664/jcsm.6888
35. Лобанов С. А. Морфофункциональная асимметрия мозга. Вестник Башкирского государственного педагогического университета им. М. Акмуллы. 2011; 2 (25): 73-88.
36. Брагина И. И., Доброхотова Т. А. Функциональные асимметрии человека. М.: «Медицина»; 1988.
37. Черноситов А. В., Орлов В. И., Васильева В. В. Функциональная межполушарная асимметрия мозга – как объект репродуктивного системогенеза. В книге: Руководство по функциональной межполушарной асимметрии. М.: Научный мир; 2009.
38. Черноситов А. В. Функциональная асимметирия мозга: медико-биологические, психологические и социально-педагогические аспекты. Издание 2-е дополн. Р/Д.: Издательство ИПО ПИ ЮФУ; 2011.
39. Пантелеева А. М., Бердичевская Е. М. Особенности проявлений симметрии-асимметрии при статической нагрузке у футболистов-правшей. Ресурсы конкурентоспособности спортсменов: теория и практика реализации. 2020; 1: 205-207.
Об авторах
Т. Л. БоташеваРоссия
Татьяна Леонидовна Боташева, д. м. н., профессор, главный научный сотрудник
акушерско-гинекологический отдел
Ростов-на-Дону
О. И. Дериглазова
Россия
Ольга Ивановна Дериглазова, врач-эндокринолог, врач-акушер-гинеколог
Ростовская область
Е. Ю. Лебеденко
Россия
Елизавета Юрьевна Лебеденко, д. м. н., профессор
кафедра акушерства и гинекологии № 3
Ростов-на-Дону
Е. В. Железнякова
Россия
Елена Васильевна Железнякова, к. м. н., научный сотрудник
акушерско-гинекологический отдел
Ростов-на-Дону
О. П. Заводнов
Россия
Олег Павлович Заводнов, к. б. н., научный сотрудник
акушерско-гинекологический отдел
Ростов-на-Дону
В. Ю. Желтецкая
Россия
Виктория Юрьевна Желтецкая, врач-терапевт участковый
Ростов-на-Дону
А. А. Улькина
Россия
Анастасия Александровна Улькина, студентка 6 курса 11б группы
лечебно-профилактический факультет
Ростов-на-Дону
Рецензия
Для цитирования:
Боташева Т.Л., Дериглазова О.И., Лебеденко Е.Ю., Железнякова Е.В., Заводнов О.П., Желтецкая В.Ю., Улькина А.А. Роль морфо-функциональных асимметрий и сомнологического статуса в патогенезе гестационного сахарного диабета у женщин с избыточной массой тела. Медицинский вестник Юга России. 2023;14(2):26-35. https://doi.org/10.21886/2219-8075-2023-14-2-26-35
For citation:
Botasheva T.L., Deriglazova O.I., Lebedenko E.Yu., Zheleznyakova E.V., Zavodnov O.P., Zheltetskaya V.Yu., Ulkina A.A. The role of morphofunctional complexes and somnological signs of the pathogenesis of gestational diabetes mellitus in overweight women. Medical Herald of the South of Russia. 2023;14(2):26-35. (In Russ.) https://doi.org/10.21886/2219-8075-2023-14-2-26-35