Перейти к:
Провоспалительные цитокины у больных с острым инфарктом миокарда на фоне хронической обструктивной болезни легких
https://doi.org/10.21886/2219-8075-2020-11-3-40-47
Аннотация
Цель: изучить и проанализировать сывороточный уровень интерлейкинов (ИЛ) ИЛ-1β, ИЛ-2 и ИЛ-6 у больных с острым инфарктом миокарда на фоне хронической обструктивной болезни легких.
Материалы и методы: всего обследовано 85 человек: 28 больных инфарктом миокарда, 37 больных коморбидной патологией (инфаркт миокарда на фоне хронической обструктивной болезни легких) и 20 соматически здоровых добровольца в качестве группы контроля. Определение уровней ИЛ-1β, ИЛ-2 и ИЛ-6 проведено методом твердофазного иммуноферментного анализа.
Результаты: в группе больных инфарктом миокарда и у больных коморбидной патологией выявлено статистически значимое повышение уровня изучаемых цитокинов по сравнению с группой контроля. Самые высокие уровни ИЛ-1β, ИЛ-2 и ИЛ-6 определялись в группе больных с коморбидной патологией. Установлено, что IL-6 является независимым маркером повышенного риска инфаркта миокарда с подъемом сегмента ST, а увеличение его концентрации позже 12 часов от момента поступления связано с риском будущей сердечно-сосудистой смерти или повторного инфаркта миокарда.
Заключение: анализ динамики уровня ИЛ-1β, ИЛ-2 и ИЛ-6 обладает высокой прогностической значимостью как у больных с инфарктом миокарда, так и у больных с коморбидной патологией.
Ключевые слова
Для цитирования:
Наумов А.В., Прокофьева Т.В., Полунина О.С., Сароянц Л.В., Полунина Е.А. Провоспалительные цитокины у больных с острым инфарктом миокарда на фоне хронической обструктивной болезни легких. Медицинский вестник Юга России. 2020;11(3):40-47. https://doi.org/10.21886/2219-8075-2020-11-3-40-47
For citation:
Naumov A.V., Prokofieva T.V., Polunina O.S., Saroyants L.V., Polunina E.A. Proinflammatory cytokines in patients with acute myocardial infarction against the background of chronic obstructive pulmonary disease. Medical Herald of the South of Russia. 2020;11(3):40-47. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-3-40-47
Введение
В последние десятилетия коморбидный больной встречается на приеме у врача чаще, чем больной с мононозологией. Одним из заболеваний, для которых коморбидность является чрезвычайно характерной, является хроническая обструктивная болезнь легких (ХОБЛ). Многочисленные исследования показали, что коморбидные хронические состояния встречаются чаще у пациентов с ХОБЛ, чем у субъектов без ХОБЛ, и способствуют неблагоприятным клиническим исходам у этих пациентов [1]. ХОБЛ по ряду клинических и лабораторных показателей усуубляет течение абсолютного большинства известных на сегодня заболеваний. Доказано, что частота сопутствующих заболеваний не зависит от степени ограничения воздушного потока при ХОБЛ, а встречается по всему спектру тяжести болезни [2].
Учитывая, что ХОБЛ и некоторые сердечно-сосудистые заболевания (ССЗ) примерно одинаково распространены и имеют одинаковые факторы риска, эти заболевания часто наблюдаются у одного и того же человека. Более 70 % людей в возрасте старше 65 лет имеют коморбидные заболевания, и в значительной части случаев, по крайней мере, одно из заболеваний имеет сердечно-сосудистую природу [2][3].
Нередко первым проявлением ишемической болезни сердца (ИБС) у пациентов с ХОБЛ является инфаркт миокарда (ИМ). Диагностика этого грозного состояния может задерживаться или вообще пропускаться в силу атипичности клиники. В нескольких исследованиях сообщалось, что пациенты с ИМ на фоне ХОБЛ с большей вероятностью будут иметь одышку, атипичные боли в груди и учащенное сердцебиение [4]. Исследование пациентов с ХОБЛ показало наличие перенесенного ИМ на электрокардиограмме у 27 %, но у большинства (70 %) данный факт не был задокументирован в истории болезни [5].
Среди пациентов с ХОБЛ сосуществующие ССЗ неизменно связаны с более высокими показателями госпитализации, внутрибольничной смертности и повторной госпитализации в течение 30 дней, а также с увеличением продолжительности пребывания в стационаре [6]. Кроме того, наличие ССЗ повышает риск и продолжительность частых обострений ХОБЛ, а возникновение обострений ХОБЛ, в свою очередь, увеличивает риск последующих сердечно-сосудистых событий у пациентов с ССЗ [7]. ССЗ не только входят в число наиболее распространенных сопутствующих заболеваний при ХОБЛ, но также связаны с повышенным риском смерти [8].
Пациенты с ХОБЛ подвержены длительной или периодической гипоксии, которая может вызывать ишемию и ИМ. Известно, что гипоксия вызывает усиление системного воспаления, окислительного стресса, образование пенистых клеток и повышенную регуляцию молекул клеточной адгезии в эндотелиальных клетках, которые могут способствовать прогрессированию атеросклероза и, следовательно, развитию ССЗ [9].
Общим патогенетическим фактором, связывающим ХОБЛ и повышенный риск развития ССЗ, является хроническое воспаление. Недавно было высказано предположение, что обострения ХОБЛ и связанный с ними приток нейтрофилов могут быть пусковыми механизмами для острых коронарных событий [10]. Инфекционные агенты приводят к воспалению в трахеобронхиальном дереве с активизацией, клеточного и гуморального звеньев иммунитета. Немаловажная роль в процессе воспаления отводится цитокиновой активации. Воспалительный каскад высвобождает медиаторы воспаления, такие как интерлейкины и хемокины, которые рекрутируют и активируют иммунные клетки. Воспалительные цитокины, продуцируемые Т-клетками и макрофагами при обострении, включая IL-1β, IL-2, IFN-γ, IL-6, TNF-α и др., влияют на функцию эндотелия, повышая его проницаемость. Активация IL-6 и фибриногена приводит к усиленной коагуляции [11]. Параллельно с формированием местного воспаления возникает системное воспаление, которое вместе с гипоксией приводит к повреждению сосудистой стенки с акселерацией процессов атерогенеза.
Таким образом, респираторно-кардиальная коморбидность у больных с ХОБЛ представляет собой серьезную диагностическую и терапевтическую проблему, в решении которой существенную роль может оказать понимание различных патофизиологических механизмов взаимоотношения ХОБЛ и ССЗ, включая и оценку цитокинового профиля. Это будет способствовать предотвращению осложнений и улучшению прогноза заболеваний.
Цель исследования — изучить и проанализировать сывороточный уровень цитокинов (ИЛ-1(1, ИЛ-2 и ИЛ-6) у больных ИМ на фоне ХОБЛ.
Материалы и методы
Для выполнения поставленной цели было обследовано 65 больных ИМ, находившихся на стационарном лечении в кардиологическом отделении регионального сосудистого центра ГБУЗ АО Александро-Мариинской областной клинической больницы (г. Астрахань) в 2018 - 2019 гг. В зависимости от наличия ХОБЛ эти больные были разделены на две группы: больные ИМ (n = 28) и больные с коморбидной патологией ИМ+ХОБЛ (n = 37). В группу сравнения вошли 20 соматически здоровых лиц. Средний возраст обследованных составил 54,8 ± 2,4 года.
Диагностика и лечение острого ИМ осуществлялись в соответствии с утвержденными стандартами. Каждая из групп больных была разделена на группы с подъемом сегмента ST (ИМпSТ) и без подъема ST (ИМбпSТ).
Диагноз ХОБЛ больным был выставлен до госпитализации по поводу ИМ на основе Клинических рекомендаций «GOLD» (2019). Все больные имели II-III степени тяжести ХОБЛ. Средняя продолжительность ХОБЛ составила 16,7 [3; 23] лет. Анамнез курения имелся у всех пациентов.
Критериями исключения из исследования стало наличие таких хронических соматических заболеваний, как артериальной гипертензии, сахарного диабета, хронических болезней почек, онкологических и психических заболеваний.
Группа контроля сформирована из лиц, проходящих диспансеризацию в поликлиниках г. Астрахани в 2018 - 2019 гг., согласно приказу Министерства здравоохранения Российской Федерации от 03.02.2015 №36ан «Об утверждении порядка проведения диспансеризации определенных групп взрослого населения». Группа контроля была сопоставима по возрасту и полу с обследуемыми больными.
Исследование соответствовало стандартам надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинской Декларации. Проведение исследования одобрено Этическим комитетом (заседание РНЭК от 15 сентября 2016, протокол №1). От каждого участника исследования получено письменное информированное согласие на участие.
Уровни ИЛ-1β, ИЛ-2 и ИЛ-6 определялись методом твердофазного иммуноферментного анализа с применением моноклональных антител с использованием наборов реагентов «Интерлейкин-1 бета-ИФА-БЕСТ», «Интерлейкин-2-ИФА -БЕСТ» и «Интерлейкин-6-ИФА-БЕСТ» («Вектор-Бест», Россия), микропланшетный фотометр «Invitrologic» (Россия), промыватель планшет «StatFax 2600» (США) и шейкер-встряхиватель «ST-3 SkyLine» (Латвия).
Статистическая обработка полученных результатов осуществлялась с использованием пакета прикладных программ Statistics. 11,0 (StatSoft, Inc.). С учетом того, что распределение признаков было отличным от нормального, для каждого показателя вычисляли медиану (Ме) и интерпроцентильные размахи (25-й и 75-й процентили). Для сравнения количественных признаков между двумя независимыми группами применяли непараметрический критерий U Манна-Уитни, при количестве групп более трех — критерий Краскела-Уоллиса. Наличие и силу связи между изучаемыми показателями оценивали с помощью непараметрического коэффициента ранговой корреляции Спирмена (r). Отличия считались статистически значимыми при р <0,05.
Результаты
У всех больных с ИМ, независимо от наличия или отсутствия ХОБЛ, уровни всех изученных цитокинов были достоверно выше, чем в группе контроля (рисунок 1). При внутригрупповом сравнении достоверные различия определялись только в уровнях ИЛ-6. У больных с коморбидной патологией (ИМ+ХОБЛ) этот показатель был достоверно выше, чем в группе с ИМ (р < 0,05).
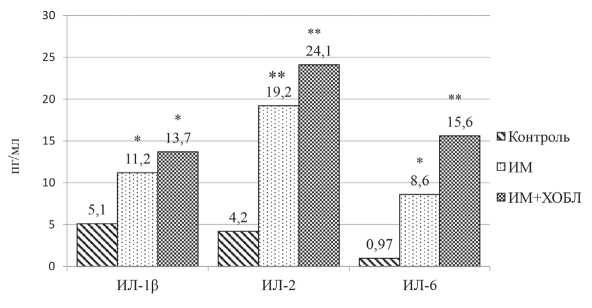
Рисунок 1. Уровни ИЛ-1β, ИЛ-2, ИЛ-6 в обследуемых группах (пг/мл).
Примечание: * — статистически значимые различия с группой контроля (* — р<0,05, ** — р<0,01)
Figure 1. Levels of IL-1β, IL-2, and IL-6 in the studied group.
Note: * — statistically significant differences with the control group (* — p<0.05, * * — p<0.01)
В настоящем исследовании также было выявлено статистически значимое повышения уровня ИЛ-1β и ИЛ-2 у больных ИМ по сравнению с группой контроля. Уровни этих интерлейкинов были повышены и у больных ИМ на фоне ХОБЛ, но различия в группах больных не были статистически значимы.
В связи с тем, что наиболее значимые межгрупповые различия при сравнении уровней цитокинов продемонстрировал ИЛ-6, представлялось целесообразным сопоставить его уровни у больных ИМ в зависимости от подъема сегмента ST (рис. 2).
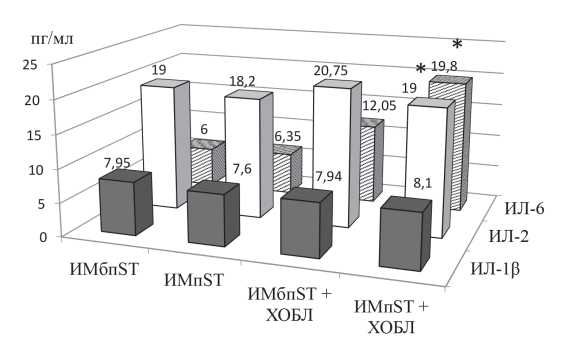
Рисунок 2. Значение уровня медианы ИЛ-1β, ИЛ-2, ИЛ-6 в зависимости от подъёма сегмента ST при ИМ (пг/мл).
Примечание: * — статистически значимые различия с группой контроля, р < 0,05.
Figure 2. The value of the median IL-1β, IL-2, IL-6 for ST-elevation MI (рg/ml).
Note: * — statistically significant differences with the control group, p < 0,05.
У больных с коморбидной патологией ИМпSТ отмечался достоверно более высокий уровень ИЛ-6 не только с группой больных ИМпSТ (р < 0,05), но с группами больных, у которых имелся ИМбпSТ (р < 0,05). Кроме того, в этой же группе по сравнению с группой ИМпSТ отмечалась тенденция к повышению уровня ИЛ-1β (р < 0,05).
Была проанализирована взаимосвязь уровней цитокинов от времени начала заболевания (рис. 3).
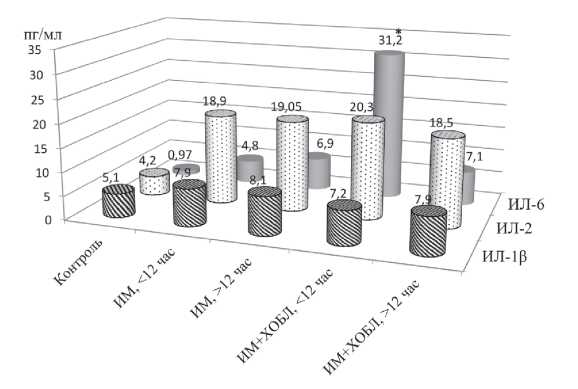
Рисунок 3. Значение уровня медианы ИЛ-1β, ИЛ-2, ИЛ-6 в зависимости от времени начала заболевания (пг/мл).
Примечание: * — статистически значимые различия с группой контроля, р < 0,05.
Figure 3. The value of the median IL-1β, IL-2, IL-6 depend of the time from onset of the disease (рg/ml).
Note: * — statistically significant differences with the control group, p < 0,05.
Как видно из рис. 3, если ИМ был диагностирован в первые часы заболевания (до 12 часов), то уровни всех изученных цитокинов возрастали независимо от сопутствующей бронхолегочной патологии. Если же ИМ диагностировался в более поздние сроки, уровень ИЛ-6 заметно возрастал в группе коморбидных больных (ИМ+ХОБЛ) (р < 0,01). По всей видимости, на более поздних стадиях помимо повреждения миокарда у коморбидных больных за счет ХОБЛ нарастает левожелудочковая недостаточность.
Обсуждение
Высокий уровень циркулирующих в крови интерлейкинов ИЛ-1β, ИЛ-2, ИЛ-6, выявленный в данной работе, подтверждается и рядом других исследователей, которые заявляют, что интерлейкины ИЛ-1b, ИЛ-6, ИЛ-2, ИЛ-8, ИЛ-18 отражают активность воспалительного процесса, а также могут являться предиктораи острых форм ИБС при наличии атеросклеротических изменений в сосудах [12].
Интерлейкин-1β является одним из ключевых медиаторов нейтрофильного воспаления дыхательных путей при ХОБЛ, и ряд авторов указывает на возможность использования его уровня в качестве маркера обострения ХОБЛ [13]. Поэтому нарушение коронарного кровотока в сочетании с нейтрофильным воспалением, по всей видимости, обусловливает наиболее высокие уровни ИЛ-1β в крови коморбидных больных.
Повышение концентрации ИЛ-2 у больных ИМ, выявленное в настоящем исследовании, согласуется с результатами ряда авторов. При этом данные в отношении концентрации ИЛ-2 у больных с сердечно-сосудистой патологией неоднозначны. Если в одних исследованиях уровень этого цитокина существенно не отличался от нормы у больных с ИБС [14], то в других исследованиях у больных со стабильной стенокардией уровень ИЛ-2 в крови был существенно повышен [15]. Han SF и соавт. обнаружили, что концентрации в плазме цитокинов, продуцируемых Thl (IFN-γ и IL-2), были значительно выше, чем концентрации, синтезированные Th2-лимфоцитами (IL-10) у пациентов с острым коронарным синдромом (ОКС) по сравнению с пациентами со стабильной стенокардией. Они также показали, что дисбаланс Th1/Th2 увеличивает цитотоксичность мононуклеарных клеток в отношении эндотелия сосудов, вызывая тем самым повреждение эндотелия у пациентов с ОКС [16]. Доказано, что Т-лимфоциты косвенно потенциируют фиброз через выработку ряда активных веществ и активацию фибробластов [17]. Поэтому выявленное повышение концентрации ИЛ-2 в группе коморбидных больных (ИМ+ХОБЛ) патогенетически значимо в развитии, а в последующем — в утяжелении сердечно-сосудистых патологии на фоне ХОБЛ. Т-лимфоциты также обнаруживаются на каждом этапе развития атеросклеротической бляшки и составляют от 10 до 22 % от общего количества клеток в атероме. Повышенный уровень ИЛ-2 в группе больных с коморбидной патологией (ИМ+ХОБЛ), повидимому, может отражать не только воспалительные реакции, имеющие системный характер, но и сопутствующую инфекционную составляющую.
ИЛ-6 играет особую роль в патогенезе атеросклероза, отражая тяжесть сердечно-сосудистой патологии. Риск ИМ увеличивался до 38 % с каждым квартилем увеличения базовых уровней IL-6 [18].
Полученные в настоящем исследовании высокие уровни ИЛ-6 у больных с острым ИМ согласуются с рядом других исследований [19]. По всей видимости, статистически значимое повышение уровня ИЛ-6 в группе больных с коморбидной патологией по сравнению с группой больных ИМ связано с изначально высокой концентрацией ИЛ-6 при ХОБЛ независимо от статуса курения [20].
Полученные данные о более высоком уровне ИЛ-6 в группе коморбидных больных с ИМпSТ подтверждаются результатами других исследователей, выявивших повышение уровней провоспалительных цитокинов у больных ИМпSТ [21]. Случаи осложненного течения ИМ на госпитальном периоде гораздо чаще регистрировались в группе коморбидных больных с ИМпSТ и у них зарегистрирован гораздо более высокий уровень госпитальной смертности, чем в группе без ХОБЛ. [22]. Ozdemir O. и соавт. продемонстрировали связь уровня IL-6 с подъемом сегмента ST заключая, что этот цитокин может рассматриваться как прогностический показатель сердечно-сосудистых событий [23].
В отношении уровня IL-1β сообщаются неоднозначные результаты при подъёме сегмента ST. Так, Kilic Т и соавт. [24] сообщили о повышенном уровне IL-1β в плазме у больных ИМпSТ, в то время как L. Dizdarevic-Hudic с соавт [25] отмечали, что только у двоих пациентов в каждой группе выявлялись определяемые концентрации IL-1β. Однако это, по мнению авторов, было связано, скорее, с чувствительностью тест-системы.
Полученные данные о зависимости уровня ИЛ-6 от сроков госпитализации согласуются с результатами работы Groot H. E. с соавт. [26], продемонстрировавшими повышение уровня ИЛ-6 через 24 часа после поступления в три раза по сравнению с исходным уровнем, что, по их мнению, свидетельствует о большем размере инфаркта и снижении сердечной функции через 4 месяца. Нарастание уровня ИЛ-6 связано с неблагоприятными внутрибольничными исходами. Это подтверждается рядом исследований, где показано, что увеличение концентрации ИЛ-6 через 48 часов после поступления связано с риском будущей сердечно-сосудистой смерти или нового инфаркта миокарда [27]. Таким образом, увеличение концентрации IL-6 при ИМ на фоне ХОБЛ в течение первых 48 часов является предиктором серьезного неблагоприятного сердечно-сосудистого события.
Выводы
- Высокий уровень циркулирующих ИЛ-1(3, ИЛ-2, ИЛ-6, выявленный в настоящем исследовании, отражает более выраженную системную воспалительную реакцию в группе коморбидных больных.
- В оценке риска развития неблагоприятных кардиоваскулярных событий у больных ИМ на фоне ХОБЛ важное место занял ИЛ-6. Повышенный уровень ИЛ-6 ассоциируется не только с активностью воспалительного процесса и повышенного риска ИМ на фоне ХОБЛ, но и является чувствительным биомаркером ИМпSТ.
- Полагая, что ИЛ-6 является потенциальной молекулой-мишенью для профилактики и улучшения течения ИМ, необходимо дополнительное изучение оценки влияния этого маркера на клинически значимые исходы ИМпSТ у больных с ХОБЛ.
Финансирование. Исследование не имело спонсорской поддержки.
Finansing. The study did not have sponsorship.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. Authors declares no conflict of interest.
Список литературы
1. Divo M., Cote C., de Torres J.P., Casanova C., Marin J.M. et al. Comorbidities and risk of mortality in patients with chronic obstructive pulmonary disease. // Am J Respir Crit Care Med. – 2012. - V. 186. - P. 155–161. https://doi.org/10.1164/rccm.201201-0034OC
2. Vanfleteren L.E., Spruit M.A., Groenen M, Gaffron S., van Empel V.P. et al. Clusters of comorbidities based on validated objective measurements and systemic inflammation in patients with chronic obstructive pulmonary disease. // Am J Respir Crit Care Med. – 2013. - V. 187. - P. 728–735. https://doi.org/10.1164/rccm.201209-1665OC
3. Barnett K., Mercer S.W., Norbury M., Watt G.G., Wyke S. et al. Epidemiology of multimorbidity and implications for health care, research, and medical education: a cross-sectional study. // Lancet. – 2012. - V. 380. - P. 37–43. https://doi.org/10.1016/S0140-6736(12)60240-2
4. Andell P., Koul S., Martinsson A., Sundström J., Jernberg T. et al. Impact of chronic obstructive pulmonary disease on morbidity and mortality after myocardial infarction. // Open Heart. – 2014. - 1:e000002. https://doi.org/10.1136/openhrt-2013-000002
5. Brekke P.H., Omland T., Smith P., Soyseth V. Underdiagnoses of myocardial infarction in COPD - Cardiac Infarction Injury Score (CIIS) in patients hospitalized for COPD exacerbation. // Respir Med. - 2008. - V. 102 - P. 1243–1247. https://doi.org/10.1016/j.rmed.2008.04.010
6. Morgan A.D., Zakeri R., Quint J.K. Defining the relationship between COPD and CVD: what are the implications for clinical practice? // Ther. Respir. Dis. - 2018. - V. 12. - P. 11–16. https://doi.org/10.1177/1753465817750524
7. Kunisaki K.M., Dransfield M.T., Anderson J.A., Brook R.D., Calverley P.M. et al. Exacerbations of chronic obstructive pulmonary disease and cardiac events: a cohort analysis. // Am J Respir Crit Care Med. – 2018. - V. 198. P. 51–557. https://doi.org/10.1164/rccm.201711-2239OC
8. Donaldson G.C., Hurst J.R., Smith C.J., Hubbard R.B., Wedzicha J.A. Increased risk of myocardial infarction and stroke following exacerbation of COPD. // Chest. – 2010. - V. 137. - P. 1091–1097. https://doi.org/10.1378/chest.09-2029
9. Linden F., Domschke G., Erbel C., Akhavanpoor M., Katus H.A., Gleissner C.A. Inflammatory therapeutic targets in coronary atherosclerosis-from molecular biology to clinical application. // Front Physiol. – 2014. - V. 5. - P. 455. https://doi.org/10.3389/fphys.2014.00455
10. Van Eeden S., Leipsic J., Paul Man S.F., Sin D.D. The relationship between lung inflammation and cardiovascular disease. // Am J Respir Crit Care Med. – 2012. - V. 186. - P. 11–16. Corpus ID: 53508730
11. Roversi S., Roversi P., Spadafora G., Rossi R., Fabbri L.M. Coronary artery disease concomitant with chronic obstructive pulmonary disease. // Eur J Clin Invest. – 2014. - V. 44. - P. 93–102. https://doi.org/10.1111/eci.12181
12. Dinarello C.A. Interleukin 1b and interleukin 18 as mediators of inflammation and the aging process. // Am.J.Clin. Nutr. - 2006. 83. - V. 2. - P. 4447-455. https://doi.org/10.1093/ajcn/83.2.447s
13. Chen B.B., Li Z.H., Gao S. Circulating miR-146a/b correlates with inflammatory cytokines in COPD and could predict the risk of acute exacerbation COPD. // Medicine (Baltimore). – 2018. - V. 97 (7). - P. e9820. https://doi.org/10.1097/MD.0000000000009820
14. Min X., Lu M., Tu S., Wang X., Pang S. et al. Serum cytokine profile in relation to the severity of coronary artery disease // Biomed Research international. - 2017. - 9 p. https://doi.org/10.1155/2017/4013685
15. Simon A.D., Yazdani S., Wang W., Schwartz A., Rabbani L.E. Elevated plasma levels of interleukin-2 and soluble IL-2 receptor in ischemic heart disease // Clin Cardiol. – 2001. - V. 24. - № 3. – P. 253-256. https://doi.org/10.1002/clc.4960240315
16. Han S.F., Li X.Y., Liu K.W., Wang L., Cui R. et al. Imbalance of T helper 1 cells/T helper 2 cells accelerated T-cell-mediated endothelium injury in patients with acute coronary syndromes. // Zhonghua Xin Xue Guan Bing Za Zhi. – 2008. - V. 36. - P. 1070–1073. Corpus ID: 8661528
17. Barczyk A., Pierzchała W., Kon O.M., Cosio B., Adcock I.M. et al. Cytokine production by bronchoalveolar lavage T lymphocytes in chronic obstructive pulmonary disease. // J Allergy Clin Immunol. - 2006. - V. 117. - № 11. – P. 1484-1492. https://doi.org/10.1016/j.jaci.2006.02.013
18. Luc G., Bard J.M., Juhan-Vague I., Ferrieres J., Evans A. et al. C-reactive protein, interleukin-6, and fibrinogen as predictors of coronary heart disease: The PRIME study. // Arterioscler Thromb Vasc Biol. – 2003. V. 23. – P. 1255-1261. https://doi.org/10.1161/01.atv.0000079512.66448.1d
19. Шаленкова М.А., Михайлова З.Д., Манюкова Э.Т., Басалгина Т.А., Шишкина А.П. Уровни содержания интерлейкинов и мелатонина у больных острым коронарным синдромом // Медицинская иммунология. - 2014. - Т. 16. - № 5.- С. 473-480. https://doi.org/10.15789/1563-0625-2017-2-191-196
20. Виткина Т.И., Денисенко Ю.К., Сидлецкая К.А. Изменение экспрессии рецептора к IL-6 на поверхности иммунокомпетентных клеток при прогрессировании хронической обструктивной болезни легких // Медицинская иммунология. – 2017. - Т. 19. - № 2. - С. 191-196. https://doi.org/10.15789/1563-0625-2017-2-191-196.
21. Passoni F., Morelli B., Seveso G., Lazzati L., Beria G. et al. Comparaitive short-term prognostic value of hemostatic and inflammatoery markers in patients with non-ST elevation acute coronary syndrome. // Ital. Heart J. – 2002. - V. 3. - P. 28-35. Corpus ID: 45088993
22. Поликутина О.М., Слепынина Ю.С., Баздырев Е.Д., Каретникова В.Н., Барбараш О.Л. Исходы инфаркта миокарда с подъемом сегмента ST у пациентов с хронической обструктивной болезнью легких в Кемеровской области. // Российский Кардиологический Журнал. – 2014. Т. 7 (111). – С. 91-97. https://doi.org/10.15829/1560-4071-2014-7-91-97
23. Ozdemir O., Gundogdu F., Karakelleoglu S., Sevimli S., Pirim I. et al. Comparison of serum levels of inflammatory markers and allelic variant of interleukin-6 in patients with acute coronary syndrome and stable angina pectoris. // Coron Artery Dis. - 2008. - V. 19. - P. 15–19. https://doi.org/10.1097/mca.0b013e3282f27bf7
24. Kilic T. Relation between proinflammatory to anti-inflammatory cytokine ratios and long-term prognosis in patients with non-ST elevation acute coronary syndrome. // Heart. – 2006. - V. 92. - P. 1041–1046. https://doi.org/10.1136/hrt.2005.080382
25. Dizdarević-Hudić L., Kušljugić Z., Baraković F., Brkić S., Sabitović D., et al. Correlation between interleukin 6 and interleukin 10 in acute myocardial infarction. // Bosn J Basic Med Sci. – 2009. - V. 9(4). - P. 301–306. https://doi.org/10.17305/bjbms.2009.2784
26. Hilde E.G., Lawien Al Ali, Iwan C.C. van der Horst, Remco A.J.S. et al. Plasma interleukin 6 levels are associated with cardiac function after ST-elevation myocardial infarction. // Clinical Research in Cardiology. – 2018. – P. 612-621. https://doi.org/10.1007/s00392-018-1387-z
27. Bennermoa M., Held C., Green F., Strandberg L.-E., Ericsson C.-G. et al. Prognostic value of plasma interleukin-6 concentrations and the −174 G > C and −572 G > C promoter polymorphisms of the interleukin-6 gene in patients with acute myocardial infarction treated with thrombolysis. // Atherosclerosis May. – 2004. V. 174 (1). – P. 157–163. https://doi.org/10.1016/j.atherosclerosis.2004.01.019
28. Аляви А.Л., Низомов А.А., Касимова Г.М. Клинико-диагностическое значение активации цитокинов и возможности коррекции нарушений у больных острым коронарным синдромом с подъемом сегмента ST. // Тезисы Российского национального конгресса кардиологов. – 2012. - №0024. - С. 43-44.
Об авторах
А. В. НаумовРоссия
Андрей Валентинович Наумов, аспирант кафедры внутренних болезней педиатрического факультета
Астрахань
Т. В. Прокофьева
Россия
Татьяна Васильевна Прокофьева, кандидат медицинских наук, доцент кафедры внутренних болезней педиатрического факультета
Астрахань
О. С. Полунина
Россия
Ольга Сергеевна Полунина, доктор медицинских наук, проф., заведующая кафедрой внутренних болезней педиатрического факультета
Астрахань
Л. В. Сароянц
Россия
Людмила Валентиновна Сароянц, доктор медицинских наук, заведующая лабораторно-экспериментальным отделом
Астрахань
Е. А. Полунина
Россия
Екатерина Андреевна Полунина, доктор медицинских наук, доцент кафедры внутренних болезней педиатрического факультета
Астрахань
Рецензия
Для цитирования:
Наумов А.В., Прокофьева Т.В., Полунина О.С., Сароянц Л.В., Полунина Е.А. Провоспалительные цитокины у больных с острым инфарктом миокарда на фоне хронической обструктивной болезни легких. Медицинский вестник Юга России. 2020;11(3):40-47. https://doi.org/10.21886/2219-8075-2020-11-3-40-47
For citation:
Naumov A.V., Prokofieva T.V., Polunina O.S., Saroyants L.V., Polunina E.A. Proinflammatory cytokines in patients with acute myocardial infarction against the background of chronic obstructive pulmonary disease. Medical Herald of the South of Russia. 2020;11(3):40-47. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-3-40-47







































