Перейти к:
Методы специфического лабораторного тестирования новой коронавирусной инфекции
https://doi.org/10.21886/2219-8075-2020-11-3-27-33
Аннотация
В обзоре представлено описание специфического лабораторного тестирования SARS-CoV-2. Показана эффективность определенных типов тестов в зависимости от поставленных медицинских и эпидемиологических задач. Также отмечена важность применения определённых методов диагностики для массового и оперативного тестирования пациентов на новую коронавирусную инфекцию, что позволит ускорить их выявление. Показана эффективность применения тест-систем, с которыми можно будет работать в амбулаторных условиях без наличия в медицинском учреждении стационарной лаборатории, что позволит упростить и увеличить пропускную способность медицинских учреждений, которые проводят диагностику SARS-CoV-2. Данный обзор будет полезен как медицинским работникам лабораторных специальностей, так и всем врачам клинического профиля, которые сейчас работают с новой коронавирусной инфекцией.
Для цитирования:
Перевезенцев О.А., Холодная Т.О., Самсонов А.Е., Бурцев Д.В. Методы специфического лабораторного тестирования новой коронавирусной инфекции. Медицинский вестник Юга России. 2020;11(3):27-33. https://doi.org/10.21886/2219-8075-2020-11-3-27-33
For citation:
Perevesentsev O.A., Cholodnaya T.O., Samsonov A.E., Burtsev D.V. Methods of specific laboratory testing of new coronavirus infection. Medical Herald of the South of Russia. 2020;11(3):27-33. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-3-27-33
Коронавирусы (CoV) (Coronoviridae) — это семейство вирусов, содержащих в качестве генетического материала одноцепочечную ( + ) РНК со специфическими гликопротеидными шипами (спайками) вокруг вирусного капсида, которые при электронном микрокопировании похожи на солнечную корону [1]. Семейство коронавирусов делится на несколько подсемейств, включающих четыре рода (от альфа- до дельта-), которые потенциально патогенны для различных видов млекопитающих, включая человека [2]. За последние 20 лет кроме ранее известных четырёх видов короавирусов у человека, входящих в структуру сезонных ОРВИ, были описаны новые более патогенные виды коронавирусов: SARS-CoV, описанный в 2002 г., который в 2002 - 2003 гг. явился причиной вспышки атипичной пневмонии в Китае; MERS-CoV, который 2012 г. вызвал вспышку ближневосточного респираторного синдрома в Саудовской Аравии и в 2015 г. в Южной Корее (MERS) и новый коронавирус SARS-CoV-2, который вызвал вспышку болезни, названной COVID19, в китайской провинции Ухань, которая на настоящее время переросла в глобальную пандемию1. Достаточно высокая степень передачи нового коронавируса (среднее медианное значение индекса репродукции 2.2, разброс 3.3-5.47) и потенциальная тяжесть последствий заболевания COVID19, вызываемого данным вирусом, превратили его в главную медицинскую проблему 2020 г. [1][3].
Изучение факторов патогенности коронавируса SARS-CoV-2 показало, что в клетки человека он проникает через рецепторы к ангиотензин-превращающему ферменту 2 типа (ACE2), который достаточно широко представлен в различных тканях: он экспрессируется в легких на уровне альвеол, кишечнике, гонадах, почках и т.д. [4]. Поэтому потенциально при новой коронавирусной инфекции могут поражаться не только дыхательные пути, но и друие ткани и органы [1][4][5]. С диагностической точки зрения, это означает, что вирусная ДНК может детектироваться не только в биоматериале из дыхательных путей (назофарингеальные соскобы, БАЛ, мокрота), но и в других биологических жидкостях (фекалии, моча, кровь) [1][4][6][7]. Также, теоретически, он может обнаруживаться в моче и в семенной жидкости у мужчин [1].
В настоящее время референсным методом диагностики новой коронавирусной инфекции SARS-CoV-2 является метод полимеразной цепной реакции в реальном времени с обратной транскрипцией вирусной РНК [8]. Из-за достаточно стремительного распространения нового коронавируса по миру особое значение приобретает максимально широкий охват данным молекулярно-генетическим тестированием населения различных стран для эффективного проведения противоэпидемических мероприятий [8]. Например, показано, что до начала глобального ограничения сообщения с Китаем как первичного источника пандемии число недиагностированных случаев инфицирования SaRS-CoV-2 примерно 79 % от общего числа, что сыграло ключевую роль в перерастании локальной вспышки коронавирусной инфекции в глобальную пандемию [9]. Показателен опыт стран, где именно за счёт широкого охвата тестами максимального количества человек удалось снизить скорость эпидемического распространения SARS-CoV-2. Например, в Южной Корее за 9 недели после первого обнаруженного случая инфицирования SARS-CoV-2 было проведено более 300 тыс. тестов (5828,6 тестов на миллион человека населения) [10][11]. Схожие подходы к тестированию были использованы в Сингапуре, Гонконге и на Тайване [12][13]. Кроме широкого охвата тестирования населения также важным является быстрое получение результата молекулярно-генетического тестирования, особенно у пациентов клиническими проявлениями COVID19, которые находятся в начале развивающегося патологического процесса, и у индивидов с бессимптомным носительством SARS-CoV-2 [8]. Быстрая молекулярно-генетическая дифференциальная диагностика COVID19 с другими респираторными патологиями, в том числе, с сезонными ОРВИ и гриппом, позволяет нивелировать внутрибольничное распространение инфекции, что является важным фактором сдерживания эпидемического процесса и снижает нагрузку на медицинскую систему в целом [14][15].
Правильная оценка результатов молекулярно-генетического тестирования должна учитывать стадийность развития патологического процесса при инфицировании SARS-CoV-22 [8]. На рис. 1 показана схема постановки диагностических задач на различных стадиях развития инфекционного патологического процесса новой коронавирусной инфекции.
Таким образом, для каждой из стадий развития инфекции SARS-CoV-2 максимально подходит только определённый тип лабораторного тестирования [8]. Дизайн теста должен соответствовать определённым параметрам: напрямую ли он детектирует вирусную ДНК (ПЦР в реальном времени с обратной транскрипцией) или же косвенно (исследование специфических антител), время выполнения исследования, его пропускная способность, его дозирование (возможность использования перед тестированием минимального количества образцов), а также возможность использования тестов в амбулатории или пункте оказания первичной медицинской помощи в случае отсутствия хорошо оснащенной молекулярно-генетической или иммунологической лаборатории. Также важным является специфичность и особенно чувствительность тест-системы. Если принять за базис стадийность степени репликации SARS-C.V-2 в зависимости от стадии заболевания и тяжести его протекания, ПЦР тесты с низкой чувствительностью подойдут для тестирования симптоматических пациентов, но у асимптомных индивидуумов могут дать ложноотрицательный результат. Разберём теперь, каким образом лучше проводить тестирование на SARS-CoV-2 c точки зрения развития заболевания и наблюдения с развитием эпидемического процесса. В задачи данного обзора не входит рассмотрение тест-систем конкретных производителей, но базисные параметры используемых лабораторных тестов рассмотреть необходимо.
В настоящее время, как уже было отмечено выше, базисным референсным методом диагностики инфекции SARS-CoV-2 является метод real-time PCR с обратной транскрипцией вирусной РНК. Но появляются новые методы диагностики рассматриваемой инфекции, в частности, иммунологические, которые для ряда задач подходят больше, чем молекулярно-генетическое исследование3 [8]. В табл. 1 представлен перечень типов специфического лабораторного тестирования нового коронавируса согласно стадийности развития заболевания и задач наблюдения за эпидемическим процессом по схеме, показанной на рис. 1.
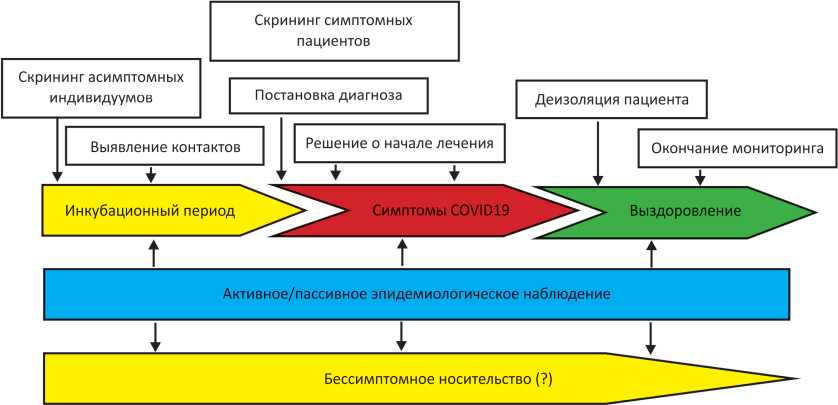
Рисунок 1. Диагностическая схема специфического лабораторного тестирования пациентов с подозрением на инфицирование SARS-CoV-2.
Figure 1. Diagnostic scheme for specific laboratory testing of patients with suspected SARS-CoV-2 infection.
В вышеприведённой таблице зелёным выделены ячейки, тесты в которых хорошо адаптированы для поставленных диагностических и прогностических задач с точки зрения точности тестирования, его формата и времени получения результата. Желтым выделены ячейки, тесты в которых доступны или разработаны для их использования в короткие сроки, но имеют существенные ограничения для своего применения (например, многие из существующих тест-систем для ПЦР в реальном времени с обратной транскрипцией могут давать ложно-отрицательные результаты у индивидуумов в инкубационном периоде с низкой вирусной нагрузкой или же у пациентов с вирусоносительством, где тоже может предполагаться низкая вирусная нагрузка). Красным выделены ячейки, которые не применяются для соответствующих поставленных задач. NAAT — тест амплификации нуклеиновых кислот (nucleic acid amplification test), который является альтернативой RT-PCR и для SARS-CoV-2 представлен методом изотермальной амплификации (TMA, LAMP).
Рассмотрим некоторые особенности забора материала для молекулярно-генетического анализа на SARS-CoV-2. CDC рекомендует брать материал из респираторного тракта [5]. В основном, анализируются назофарингеальные соскобы, но могут проводить анализ и орофарингеальных соскобов из средней носовой раковины и передней носовой полости4 [16]. Для забора образцов предпочтительней использовать алюминиевые или пластиковые зонды с ватными тампонами, причем для увеличения концентрации вирусных частиц в образце желательно материал, полученный из разных отделов респираторного тракта, помещать в одну пробирку с универсальной транспортной средой. Для анализа также может использоваться мокрота, БАЛ и эндотрахеальный аспират, молекулярно-генетическии анализ которых может дать, в ряде случаев. Более надежный результат, чем пробы, взятые из верхних дыхательных путей, так как вирус SARS-CoV-2 более тропен к клеткам нижних отделов респираторного тракта [5].
В США для молекулярно-генетического тестирования новой коронавирусной инфекции применяется одобренный CDC тестовый набор, который содержит праймеры к двум локусам вирусного нуклеокапсида (N1 и N2) и для гена человеческой РКАазы P [8]. Данный набор отличается от рекомендованного ВОЗ, в котором используются праймеры к генам SARS-CoV РНК-зависимой РНК-полимеразы (RdRP) и капсидного белка (E) [17]. Оба тестовых набора обладают достаточно высокой аналитической чувствительностью и специфичностью и минимальной перекрёстной реакцией с другими циркулирующими видами коронавирусов, причем порог положительного результата в обоих тестах находится до 40-го цикла амплификации [8]. Данные тесты могут использоваться как в качестве скрининговых, так и в качестве подтверждающих и в референсных лабораториях, и в лабораториях, выполняющих массовое тестирование. Также FDA одобрено около 20 коммерческих тестов, которые могут быть использованы молекулярно-генетическими лабораториями для расширения тестирования на новый коронавирус. Что касается компонентов диагностического набора, рекомендованного ВОЗ, то показано, что диагностические ПЦР тест системы, основанные на выявлении специфической последовательности E гена SARS-CoV-2, являются более чувствительными, чем основанные на выявлении RdRp, но в первых из них может быть затруднена интерпретация результата из-за высокой зависимости качества ПЦР от сторонних факторов [18].
Таблица / Table 1
Релевантность методов специфического лабораторного тестирования на новую коронавирусную инфекцию для выполнения определенных медицинских задач
Relevance of methods of specific laboratory testing for a new coronavirus infection for performing certain medical tasks

Для быстрого молекулярно-генетического анализа в режиме «полевых условий» амбулаторных учреждений здравоохранения первичного медицинского звена новой коронавирусной инфекции FDA был одобрен ряд тестсистем, с которыми может медицинский персонал вне стационарных лабораторий. Данные тесты позволяют получить результат максимум за 1 час, работа с ними не требует особой лабораторной квалификации. Это тест-системы в виде готовых картриджей, работающих на платформах Abbott ID NOW (Abbott Laboratories), BioFire FilmArray (bioMer rieux), cobas Liat (Roche Diagnostics), и GeneXpert (Cepheid) [19]. Использование таких тестсистем, которые быстро дают результат вне лаборатории, может иметь решающее значение для быстрого выявления инфицированных новым коронавирусом. Например, такие тесты на базе платформы GeneXpert хорошо себя зарекомендовали для массового быстрого тестирования таких социально значимых инфекций, как туберкулез или ВИЧ [8]. Поэтому благодаря их пропускной способности можно будет проводить массовое тестирование на SARS-CoV-2 в странах и регионах со слабо развитой стационарной лабораторной службой, хотя у таких аналитических систем могут быть определённые ограничения касательно их чувствительности и специфичности.
Рассмотрим теперь кратко перспективы использования иммунологических тестов на новую коронавирусную инфекцию. Касательно тестов ни вирусный антиген, как показывает практика иммунологического тестирования антигенов вирусов гриппа респираторно-синтициальной инфекции, данные тест-системы могут давать результаты в амбулаторных условиях первичного медицинского звена за время порядка минут [20]. Но такой тип тест-систем для выше указанных сезонных ОРВИ показывает неоптимальную чувствительность для подтверждения случая заболевания. Для нового коронавируса такие иммунологические тесты сейчас активно разрабатываются, причем их основой служат моноклональные антитела к нуклеокапсидному белку5 [21]. Касательно же серологических тестов на специфические антитела класса IgA, IgM, и IgG, то для возможности их использования ситуация двоякая. С одной стороны, метод ИФА на поиск антител в периферической крови или слюне может быть проще по исполнению, чем все молекулярно-генетические методы, поэтому его можно использовать в определённых ситуациях [9][22]. Однако данный метод имеет ряд ограничений, таких как зависимость от времени начала симптомов, когда, как уже отмечалось выше, пациент наиболее активно выделяет вирусные частицы в окружающуо среду, инерционность активной выработки антител на инфекционный агент (антитела образуются через несколько дней до недели в количестве, достаточном для их обнаружения), перекрёстная реакция с другими видами коронавирусов человека [21][22]. Данные серологические тесты могут быть полезны у пациентов сна поздних стадиях заболевания, когда снижается репликация и активное вирусовыделение SAES-CoV-2, в этом случае молекулярно-генетические тесты дадут ложноотрицательный результат. Ряд исследований, например, показывает почти 100 % корреляции между положительным анализом методом RT-PCR и уровнем выработанных специфических антител класса IgM, и IgG методом ИФА у пациентов, госпитализированных с симптомами COVID19 [23]. Также, как показано на выше приведенной схеме, такие тесты незаменимы для эпидемиологического наблюдения и эпидемиологических исследований, могут также применяться для разработки вакцинных препаратов и вакцин против нового коронавируса и. потенциально, полезны для медицинских работников, причем. Необязательно напрямую контактирующих с больными COVID19.
Резюмируя данный обзор, можно отметить следующее. Несмотря на активное развитие в настоящее время методов специфической лабораторной диагностики коронавирусной инфекции, к базисным методам (RT-PCR и серологические тесты) остается ещё много вопросов. Определённый тип тестов подходит только к определённой фазе развития патологического процесса. И главная проблема — точное выявление бессимптомных носителей инфекции и пациентов в инкубационном периоде. Учитывая достаточную длительность инкубации при COVID19 (в среднем, 5 - 6 дней, но возможно увеличение вплоть до 2-х недель) данные индивидуумы могут играть ключевуо роль в развитии эпидемического процесса. Следует также отметить то факт, что до конца не изучена стадийность репликации и вирусовыделения SARS-CoV-2 при бессимптомном носительстве, что также усложняет точное выявление новой коронавирусной инфекции. Поэтому на данный момент необходима разработка тестов для выявление SARS-CoV, которые базировались бы не только свойствах этиологического агента, но и на особенностях патогенеза данной инфекции. Разработка таких тестов может сыграть решающую роль в выявлении асимптомных носителей заболевания, позволит уточнить особенности его этиопатогенеза и, в конечном итоге, взять под полный контроль развитие эпидемического процесса [24].
Финансирование. За счёт ГАУ РО Областной консультативно-диагностический центр.
Financing: at the cost Regional consulting and diagnostic center, Rostov-on-Don.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. Authors declares no conflict of interest.
1. Center for Systems Science and Engineering (2020) CoronavirusCOVID-19 global cases. Johns Hopkins University. Accessed 3 Apr 2020. https://coronavirus.jhu.edu/map.html
2. FIND. COVID-19 Diagnostics Resource Centre. http://www.finddx.org/covid-19/
3. FIND. COVID-19 Diagnostics Resource Centre. http://www.finddx.org/covid-19/
4. Centers for Disease Control and Pevention. Interim Guidelines for Collecting, Handling, and Testing Clinical Specimens from Persons for Coronavirus Disease 2019 (COVID-19).
https://www.cdc.gov/coronavirus/2019-nCoV/lab/guidelines-clinical-specimens%20html
5. FIND. SARS-CoV-2 Diagnostic Pipeline. https://www.finddx.org/covid-19/pipeline/
Список литературы
1. Paoli D, Pallotti F, Colangelo S, Basilico F, Mazzuti L, Turriziani O, et al. Study of SARS-CoV-2 in semen and urine samples of a volunteer with positive naso-pharyngeal swab. // J Endocrinol Invest. – 2020. – V.23. – P.1–4. https://doi.org/10.1007/s40618-020-01261-1
2. Ashour HM, Elkhatib WF, Rahman MM, Elshabrawy HA. Insights into the Recent 2019 Novel Coronavirus (SARSCoV-2) in Light of Past Human Coronavirus Outbreaks. // Pathogens. – 2020. – V.9(3). – P.186. https://doi.org/10.3390/pathogens9030186
3. Cascella M, Rajnik M, Cuomo A, Dulebohn SC, Di Napoli R. Features, Evaluation, and Treatment of Coronavirus (COVID-19) [Updated 2020 Aug 10]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK554776/
4. Chen Y, Guo Y, Pan Y, Zhao ZJ. Structure analysis of the receptor binding of 2019-nCoV. // Biochemical and Biophysical Research Communications. – 2020. – V.525, Is.1. – P. 135-140. https://doi.org/10.1016/j.bbrc.2020.02.071.
5. Corman VM, Landt O, Kaiser M, Molenkamp R, Meijer A, Chu DK, et al. Detection of 2019 novel coronavirus (2019- nCoV) by real-time RT-PCR. // Euro Surveill. – 2020. – V.25(3). -2000045. https://doi.org/10.2807/1560-7917.ES.2020.25.3.2000045.
6. Xie C, Jiang L, Huang G, Pu H, Gong B, Lin H, et al. Comparison of different samples for 2019 novel coronavirus detection by nucleic acid amplification tests. // Int J Infect Dis. – 2020. – V.93. – P.264-267. https://doi.org/10.1016/j.ijid.2020.02.050.
7. Peng X, Xu X, Li Y, Cheng L, Zhou X, Ren B. Transmission routes of 2019-nCoV and controls in dental practice. // International Journal of Oral Science. – 2020. – V.12(1). https://doi.org/10.1038/s41368-020-0075-9
8. Cheng MP, Papenburg J, Desjardins M, Kanjilal S, Quach C, Libman M, et al. Diagnostic Testing for Severe Acute Respiratory Syndrome–Related Coronavirus-2. A Narrative Review. // Ann Intern Med. – 2020. – V. 172(11). – P. 726-734. https://doi.org/10.7326/M20-1301.
9. Li R, Pei S, Chen B, Song Y, Zhang T, et al. Substantial undocumented infection facilitates the rapid dissemination of novel coronavirus (SARS-CoV-2). // Science. – 2020. – V. 368(6490). – P. 489-493. https://doi.org/10.1126/science.abb3221
10. Sheridan C. Fast, portable tests come online to curb coronavirus pandemic. // Nat Biotechnol. – 2020. – V. 38(5). – P. 515-518. https://doi.org/10.1038/d41587-020-00010-2
11. Korean Society of Infectious Diseases; Korean Society of Pediatric Infectious Diseases; Korean Society of Epidemiology; Korean Society for Antimicrobial Therapy; Korean Society for Healthcare-associated Infection Control and Prevention; Korea Centers for Disease Control and Prevention. Report on the Epidemiological Features of Coronavirus Disease 2019 (COVID-19) Outbreak in the Republic of Korea from January 19 to March 2, 2020. // J Korean Med Sci. – 2020. – V. 35(10). - :e112. https://doi.org/10.3346/jkms.2020.35.e112
12. Lee VJ, Chiew CJ, Khong WX. Interrupting transmission of COVID-19: lessons from containment efforts in Singapore. // J Travel Med. – 2020. – V. 27(3). - taaa039. https://doi.org/10.1093/jtm/taaa039.
13. Wang CJ, Ng CY, Brook RH. Response to COVID-19 in Taiwan. // JAMA. – 2020. – V. 323(14). – P.1341. https://doi.org/10.1001/jama.2020.3151
14. Webb GF, Blaser MJ, Zhu H, Ardal S, Wu J. Critical role of nosocomial transmission in the toronto sars outbreak. // Math Biosci Eng. – 2004. – V. 1(1). – P.1-13. https://doi.org/10.3934/mbe.2004.1.1.
15. Wong T, Wallington T, McDonald LC, Abbas Z, Christian M, et al. Late recognition of SARS in nosocomial outbreak, Toronto. // Emerg Infect Dis. – 2005. – V.11(2). – P.322-5. https://doi.org/10.3201/eid1102.040607.
16. Zou L, Ruan F, Huang M, Liang L, Huang H, et al. SARSCoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. N // Engl J Med. – 2020. – V. 382(12). – P.1177-1179. https://doi.org/10.1056/NEJMc2001737.
17. Wang W, Xu Y, Gao R, Lu R, Han K, et al. Detection of SARSCoV-2 in Different Types of Clinical Specimens. // JAMA. – 2020. – V. 323(18). – P.1843–4. https://doi.org/10.1001/jama.2020.3786.
18. Konrad R, Eberle U, Dangel A, Treis B, Berger A, et al. Rapid establishment of laboratory diagnostics for the novel coronavirus SARS-CoV-2 in Bavaria, Germany, February 2020. // Euro Surveill. – 2020. – V.25(9). - 2000173. https://doi.org/10.2807/1560-7917.ES.2020.25.9.2000173.
19. A Hogan C, Caya C, Papenburg J. Rapid and simple molecular tests for the detection of respiratory syncytial virus: a review. // Expert Rev Mol Diagn. – 2018. – V.18(7). – P.617-629. https://doi.org/10.1080/14737159.2018.1487293.
20. Prendergast C, Papenburg J. Rapid antigen-based testing for respiratory syncytial virus: moving diagnostics from bench to bedside? // Future Microbiol. – 2013. – V.8(4). – P. 435-44. https://doi.org/10.2217/fmb.13.9.
21. Guo L, Ren L, Yang S, Xiao M, Chang D, et al. Profiling Early Humoral Response to Diagnose Novel Coronavirus Disease (COVID-19). // Clin Infect Dis. – 2020. – V. 71(15). – P. 778- 785. https://doi.org/10.1093/cid/ciaa310.
22. Patrick DM, Petric M, Skowronski DM, Guasparini R, Booth TF, et al. An Outbreak of Human Coronavirus OC43 Infection and Serological Cross-reactivity with SARS Coronavirus. // Can J Infect Dis Med Microbiol. – 2006. – V.17(6). – P.330-6. https://doi.org/10.1155/2006/152612.
23. Infantino M, Grossi V, Lari B, Bambi R, Perri A, Manneschi M, et al. Diagnostic accuracy of an automated chemiluminescent immunoassay for anti‐SARS‐CoV‐2 IgM and IgG antibodies: an Italian experience. // Journal of Medical Virology. – 2020. – V.92(9). – P. 1671-1675. https://doi.org/10.1002/jmv.25932
24. Бурцев Д.В., Аванян Н.Л., Кипайкин В.А., Скрипец Н.В. О системе эпидемиологической безопасности в областном консультативно-диагностическом центре. // Инфекция и иммунитет. - 2017. - № S. - С. 113. eLIBRARY ID: 35379622
Об авторах
О. А. ПеревезенцевРоссия
Перевезенцев Олег Александрович, кандидат медицинских наук, ассистент кафедры персонализированной и трансляционной медицины
Ростов-на-Дону
Т. О. Холодная
Холодная Татьяна Олеговна, кандидат медицинских наук, ассистент кафедры персонализированной и трансляционной медицины
Ростов-на-Дону
А. Е. Самсонов
Самсонов Андрей Евгеньевич, заведующий учебной частью персонализированной и трансляционной медицины
Ростов-на-Дону
Д. В. Бурцев
Бурцев Дмитрий Владимирович, доктор медицинских наук, доцент, заведующий кафедрой персонализированной и трансляционной медицины
Ростов-на-Дону
Рецензия
Для цитирования:
Перевезенцев О.А., Холодная Т.О., Самсонов А.Е., Бурцев Д.В. Методы специфического лабораторного тестирования новой коронавирусной инфекции. Медицинский вестник Юга России. 2020;11(3):27-33. https://doi.org/10.21886/2219-8075-2020-11-3-27-33
For citation:
Perevesentsev O.A., Cholodnaya T.O., Samsonov A.E., Burtsev D.V. Methods of specific laboratory testing of new coronavirus infection. Medical Herald of the South of Russia. 2020;11(3):27-33. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-3-27-33







































