Перейти к:
Особенность микробиоты толстой кишки у пациентов с разными фенотипами ожирения (пилотное исследование)
https://doi.org/10.21886/2219-8075-2020-11-2-38-45
Аннотация
Цель: изучить микробиоту толстой кишки у пациентов с различными типами ожирения и у здоровых людей.
Материалы и методы: обследованы 37 человек (средний возраст 39,6 ± 4,2 года) за период 2018 – 2019 гг. Сформированы три клинические группы. I группа (n = 11) — здоровые люди с нормальной массой тела (контроль), II группа (n = 13) — пациенты с метаболически здоровым ожирением, III группа (n = 13) — с ожирением и метаболическими нарушениями. У всех пациентов исследованы основные метаболические показатели и выполнена количественная оценка состояния микробиоценоза толстой кишки.
Результаты: у обследуемых I, II и III групп в фекалиях, по сравнению с формально-нормативными количественными показателями, наблюдаются однонаправленные изменения, характеризующиеся снижением (p < 0,05) Lactobacillus spp., Bifi dobacterium spp., B. thetaiotaomicron и повышением (p < 0,05) Enterobacter spp. / Citrobacter spp. Изменения микробиоты толстой кишки во II и III группах характеризуются появлением Proteus spp. и Klebsiella spp. (9,1 % и 8,3 % соответственно). Только в III группе в фекалиях обнаружены C. diffi cile (8,3 %) и повышена частота обнаружения банальных E.сoli. Количество F.рrausnitzii было снижено (р < 0,05) в III группе, по сравнению с I группой.
Выводы: полученные в результате пилотного исследования данные свидетельствуют об изменениях микробиоты толстой кишки у людей с разными фенотипами ожирения.
Для цитирования:
Волкова Н.И., Набока Ю.Л., Ганенко Л.А., Оксенюк О.С. Особенность микробиоты толстой кишки у пациентов с разными фенотипами ожирения (пилотное исследование). Медицинский вестник Юга России. 2020;11(2):38-45. https://doi.org/10.21886/2219-8075-2020-11-2-38-45
For citation:
Volkova N.I., Naboka Y.L., Ganenko L.A., Оksenuk O.S. A feature of the microbiota of the colon in patients with different phenotypes of obesity (pilot study). Medical Herald of the South of Russia. 2020;11(2):38-45. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-2-38-45
Введение
Распространенность ожирения и избыточной массы тела во всем мире за последние три десятилетия возросла более чем на 27 %, в результате чего число заболевших людей достигло примерно 2,1 миллиарда [1]. Прогнозируется, что к 2030 г. почти 40 % населения мира будет иметь избыточный вес, а каждый пятый будет страдать ожирением [2]. Известно, что ожирение является одним из основных факторов, вызывающих различные хронические заболевания, включая сердечно-сосудистые, неалкогольную жировую болезнь печени, сахарный диабет 2 типа и некоторые виды рака [3].
В настоящее время большой интерес исследователей сфокусирован на концепции «не все ожирение одинаково», то есть есть подгруппа людей с ожирением, но без нарушения метаболического профиля. Такой фенотип ожирения назван «метаболически здоровым ожирением» (MЗO). MЗO характеризуется отсутствием метаболических нарушений, таких как дислипидемия, инсулинорезистентность, артериальная гипертония и неблагоприятный воспалительный профиль [4]. За последнее десятилетие появляется все больше фактов, указывающих, что микробиота толстой кишки является потенциальным фактором, участвующим в патофизиологии как ожирения, так и связанных с ним нарушений обмена веществ [5].
Цель исследования — изучить микробиоту толстой кишки у пациентов с различными типами ожирения.
Материалы и методы
Проведено когортное одномоментное одномоментное исследование в соответствии с международными стандартами GCP на базе кафедры внутренних болезней № 3, кафедры микробиологии и вирусологии № 1, центральной научно-исследовательской лаборатории ФГБОУ ВО Ростовского государственного медицинского университета Министерства здравоохранения РФ в период 2018 - 2019 гг.
Для реализации цели исследования были обследованы 37 пациентов и сформированы три клинические группы. Критерии включения для всех групп — отсутствие приема антибиотиков, пребиотических и пробиотических препаратов в течение трёх месяцев до включения в исследование, информированное согласие на участие в исследовании. Дополнительные критерии включения в I группу (группа контроля) — индекс массы тела (ИМТ) < 24,9кг/м2, отсутствие метаболических нарушений; во II группу — ИМТ > 24,9 кг/м2, отсутствие метаболических нарушений; в III группу — ИМТ > 24,9 кг/м2, наличие метаболических нарушений. Критерии исключения для всех групп — тяжелые соматические заболевания (хроническая почечная недостаточность, хроническая печеночная недостаточность, хроническая сердечная недостаточность), заболевания желудочно-кишечного тракта (неспецифический язвенный колит, болезнь Крона), любое острое заболевание, депрессия, алкоголизм, беременность.
Первичное обследование включало сбор жалоб, анамнеза, стандартное клиническое обследование по системам органов, оценку атропометрических показателей, таких как масса тела, рост, расчет ИМТ путем деления массы тела в килограммах на квадрат роста в метрах (Всемирная организация здравоохранения (ВОЗ), 2003 г.), измерение окружности талии (ОТ) — середина расстояния между нижним ребром и подвздошным ребром (National Institutes of Health, 2007), артериального давления (АД) и анкетирование с помощью специально разработанного опросника, содержащего разделы, посвященные стилю питания, уровню физической нагрузки, способу рождения (через естественные пути или кесарево сечение), виду вскармливания (грудное или с помощью питательной смеси).
Лабораторное обследование включало определение аланинаминотрансферазы (АЛТ), аспартатаминотранс- феразы (АСТ), глюкозы, триглицеридов (ТГ), общего холестерина (ОХС), холестерина липопротеинов низкой (ЛПНП) и высокой плотности (ЛПВП) в сыворотке крови. Исследовали на спектрофотометре Hitachi U-2900 (Япония) наборами реагентов «Ольвекс Диагностикум» (Россия). Методом твердофазного иммуноферментного анализа в сыворотке крови коммерческими наборами определяли: адипонектин (MD-E09 Mediagnost GmbH, Германия), фетуин-A (RD191037100 BioVendor, Чехия), инсулин (EIA2935 DRG International Inc, США), С-реактивный белок, ультрачувствительный (EIA3954 DRG International Inc, США) с использованием анализатора Victor 2 (Финляндия).
Для оценки состояния углеводного обмена у пациентов без сахарного диабета (СД) в анамнезе проводился оральный глюкозотолерантный тест (ОГТТ) с 75 г глюкозы по протоколу, предложенному ВОЗ [1985 г.], У пациентов с СД в анамнезе углеводный обмен оценивался с помощью определения уровня глюкозы крови натощак. Интерпретацию результатов осуществляли в соответствие с диагностическими критериями СД и других нарушений углеводного обмена. Для определения инсулиновой резистентности рассчитывался индекс Нота-IR по формуле инсулин натощак (мкМЕ/мл) х глюкоза крови натощак (ммоль/л ) /22,5. Инсулиновая резистентность диагностировалась при показателе индекса Нота-IR > 2.77. Поскольку в настоящее время нет единых дефиниций определения метаболически здорового фенотипа ожирения, нами были использованы критерии Wildmana [6]. Клинико-лабораторная характеристика исследуемых групп представлена в таблице 1.
Количественную оценку состояния микробиоценоза толстого кишечника проводили методом Real-time PCR набором «Колонофлор 16» («АЛЬФАЛАБ», Россия) с помощью детектирующего амплификатора «ДТлайт» («ДНК-Технология», Россия) Сбор образцов кала осуществлялся согласно рекомендациям отраслевого стан- дарта1. Проведение научно-исследовательской работы одобрено ЛНЭК ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России. Выписка из протокола No 20/19 от 12.12.2019. Статистическую обработку данных выполняли в R (версия 3.2, R Foundation for Statistical Computing, Vienna, Austria). Сравнение количественных характеристик (медиана) микроорганизмов, верифицированных в толстой кишке, проводили с помощью теста Краскала-Уоллиса (попарные апостериорные сравнения производились с помощью метода Неменьи). Различия признавались статистически значимыми на уровне р < 0,05. В работе был проведен кластерный анализ с построением дендрограмм. Различия между объектами оценивались на основе уровней концентраций и частот встречаемости признака. Для анализа сходства использовался метод Варда (расстояние Брея-Кёртиса). Оценку значимости различий между паттернами проводили методом PERMANOVA, основанным на тестах перестановок для матрицы индексов Брея-Кёртиса (Сёренсена) для всех наблюдений.
Таблица / Table 1
Клинико-лабораторная характеристика пациентов I, II и III групп
Clinical and laboratory characteristics of patients of groups I, II and III
Показатели Descriptor | Группа I Group I n=11 | Группа II Group II n=13 | Группа III Group III n=13 | Р |
Возраст, лет Age | 28,9±3,5 | 38,3±4,2 | 49,8±3,9 | <0,01 |
ИМТ, кг/м2 BMI | 19.8[18.4;22] | 32.5[31;35] | 32[31;34] | <0.0001 |
ОТ, см WC | 73 [68; 74.5] | 104 [100;111] | 106 [100; 12] | <0.0001 |
Глюкоза натощак, ммоль/л Fasting glucose | 5.06 [4.25; 5.2] | 4.88 [4.7; 5.3] | 6.1 [5.32; 8.25] | 0,007 |
Глюкоза через 2 часа после ОГТТ с 75 гр. глюкозы, ммоль/л 2 hours after test plasma glucose | 5.3 [4.46;5.75] | 5.77 [5.04; 6.4] | - | 0,2 |
HOMA NOMA | 1.86 [1.47;2.82] | 3.75 [2.07; 7.27] | 5.11 [4.55;10.8] | 0,001 |
OХС, ммоль/л Total-C | 4.63 [4.41;5.81] | 5.35 [4.5; 5.95] | 5.59 [4.8; 6.17] | 0,4 |
ЛПВП, ммоль/л HDL-C mmol/l | 1.94 [1.5; 2.34] | 1.6 [1.38; 1.84] | 1.5 [1.24; 1.77] | 0,6 |
ЛПНП, ммоль/л LDL-C | 2.7 [2.3; 3.01] | 3.12 [2.69; 4.22] | 3.7 [2.28; 4.09] | 0,2 |
ТГ, ммоль/л TAG, mmol/L | 0.83 [0.47;1.23] | 1.19 [0.84; 1.6] | 1.69 [1.15;2.75] | 0,02 |
ИРИ, мкЕд/мл insulin | 9.3 [7.49; 15.1] | 18.8 [9.48; 31.3] | 21.6 [15.5;38.9] | 0,02 |
СРБ, мг/л CRP | 1.21 [0.57;2.04] | 2.65 [1.31; 5.12] | 4.07 [1.11;5.12] | 0,043 |
АЛТ, ммоль/л ALT | 0.6 [0.26; 1.02] | 0.37 [0.21; 0.67] | 0.61 [0.54;0.77] | 0,2 |
АСТ, ммоль/л AST | 0.35 [0.28;0.47] | 0.38 [0.28; 0.55] | 0.46 [0.35;0.51] | 0,4 |
Адипонектин, мкг/мл Adiponectin | 15.4 [11.1;20.1] | 9.62 [7.59; 12.1] | 8.74 [4.84;11.5] | 0,004 |
Фетуин А, мкг/мл Fetuin-A | 362 [288; 406] | 292 [276; 323] | 327 [212; 344] | 0,3 |
Примечания: ИМТ — индекс массы тела, ОТ — окружность талии, HOMA — Homeostatic Model Assessment of Insulin Resistance, ОХС — общий холестерин, ЛПВП — липопротеиды высокой плотности, ЛПНП — липопротеиды низкой плотности, ТГ — триглицериды, ИРИ — иммунореактивный инсулин, СРБ — С-реактивный белок, АЛТ — аланинаминотрансфераза, АСТ — аспартатами- нотрансфераза, «p» — межгрупповой анализ.
Notes: BMI — body mass index, WC — waistline, HOMA — Homeostatic Model Assessment of Insulin Resistance, Total-C — total cholesterol, HDL-C — high density lipoproteins, LDL-C — low density lipoproteins, TAG — triglycerides, insulin — immunoreactive insulin, CRP — C-reactive protein, ALT — alanine aminotransferase, AST — aspartate aminotransferase, “p” — intergroup analysis.
Результаты
У обследуемых I, II и III групп в фекалиях по сравнению с формально-нормативными количественными показателями, приведенными в стандарте «Колонофлор 16», наблюдали однонаправленные изменения, характеризующиеся снижением (p<0,05) Lactobacillus spp., Bifidobacterium spp., B. thetaiotaomicron и повышением (p<0,05) общей бактериальной массы, Enterobacter spp. / Citrobacter spp. (табл. 2).
У обследуемых I группы помимо вышеуказанных изменений в одном случае (9,1 %) в фекалиях верифицировали Candida spp. в количестве превышающим формально-допустимые и C. perfringens. У трех пациентов (27,3 %) обнаружены P.micra. Необходимо отметить, что количественные характеристики для двух последних видов отсутствует в нормативных показателях. Однако у обследуемых I группы (из данных анамнеза) отсутствовали жалобы на дисфункцию кишечника. Они до момента настоящего исследования никогда не обращались к гастроэнтерологу и не проводили изучение микробиоты толстой кишки. Таким образом, полученные результаты можно считать формально-нормативными для конкретного региона, возраста, этнической группы. У обследуемых II и III групп в фекалиях также обнаружены C.perfringens. В нормативных показателях приводят лишь количественные результаты без частот обнаружения исследуемых таксонов. Интересным представлялось следующее обстоятельство, частота обнаружения C.perfringens нарастала (p>0,05) по вектору 1^ 2 -43 группы (18,2 %, 23,1 %, 30,8 % соответственно). Несколько иную тенденцию наблюдали в частоте обнаружения P.micra с максимальным значением во II группе (38,5 %) по сравнению с аналогичными показателями в I (27,3 %) и III (30,8 %) группах.
Таблица / Table 2
Сравнение количественных показателей микробиоты толстой кишки у исследуемых I, II и III групп с формально-нормативными
Comparison of quantitative indicators of colon microbiota in the studied groups I, II and III withformal-normative ones
Показатель Descriptor | Норма Normal rang | Группа I Group I n=11 | р | Группа II Group II n=13 | р | Группа III Group III n=13 | р |
Общая бактериальная масса total bacterial number | <1012 | 124[11;12] | 0,018 | 12[11;12] | 0,013 | 11[11;12] | 0,005 |
Lactobacillus spp. | 107-108 | 6[5;6] | 0,003 | 5[5;6] | 0,001 | 6[5;7] | 0,012 |
Bifidobacterium spp. | 109-1010 | 5[5;5] | 0,002 | 5[5;7] | 0,002 | 5[5;8] | 0,002 |
Escherichia coli | 107-108 | 6[6;6] | 0,66 | 6,5[5;8] | 0,58 | 6[5;8] | 0,08 |
Escherichia coli enteropathogenic | <104 | 0[0;0] | NGV | 6[6;6] | NGV | 0[0;0] | NGV |
Bacteroides fragilis group | 109-1012 | 11[10.5;12] | 1 | 11.5[10.5;12] | 1 | 11[11;11] | 1 |
Faecalibacterium prausnitzii | 108-10u | 11[10;11] | 1 | 10[10;10] | 0,12 | 10[9;10] | 1 |
Klebsiella pneumoniae | <104 | 0[0;0] | NGV | 5[5;5] | 0,02 | 6[5;8] | 0,03 |
Klebsiella oxytoca | <104 | 0[0;0] | NGV | 5[5;5] | 0,03 | 6[6;6] | 0,04 |
Candida spp. | <104 | 14[14;14] | NGV | 0[0;0] | NGV | 0[0;0] | NGV |
Staphylococcus aureus | <104 | 14[14;14] | NGV | 0[0;0] | NGV | 0[0;0] | NGV |
Enterococcus spp. | <108 | 5[5;5] | 1 | 5[5;5] | 1 | 5[5;6] | 1 |
Bacteroides thetaiotaomicron | 109-1012 | 8.5[8;9] | 0,006 | 9[8;9] | 0,031 | 8[7;8] | 0,008 |
Clostridium perfringens | 0 | 6,5[6;7] | NGV | 6[6;7] | NGV | 6[6;7] | NGV |
Clostridium difficile | 0 | 0[0;0] | NGV | 0[0;0] | NGV | 9[9;9] | NGV |
Proteus spp. | <104 | 0[0;0] | NGV | 6[6;6] | 0,03 | 5[5;5] | 0,02 |
Enterobacter spp. / Citrobacter spp | <104 | 7[6;7] | 0,002 | 7[7;8] | 0,0007 | 8[5;8] | 0,001 |
Fusobacterium nucleatum | 0 | 0[0;0] | NGV | 0[0;0] | NGV | 0[0;0] | NGV |
Parvimonas micra | 0 | 7[7;7] | NGV | 6[6;6] | NGV | 6[6;6,5] | NGV |
Salmolella spp. | 0 | 0[0;0] | NGV | 0[0;0] | NGV | 0[0;0] | NGV |
Shigella spp. | 0 | 0[0;0] | NGV | 0[0;0] | NGV | 0[0;0] | NGV |
Отношение Bacteroides fragilis group/Faecalibacterium prausnitzii | 0,01-100 | 3[0,01;6.67] | 1 | 5[0.01;20] | 0,99 | 6.88[3.12;35] | 1 |
Примечание: 1 — степень встречаемости показателя.
Note: 1 — the degree of occurrence of the indicator.
Однако полученные в исследуемых группах показатели не имели значимых отличий (p>0,05). Изменения микробиоты толстой кишки во II и III группах характеризовались появлением в фекалиях представителей семейства Enterobacteriaceae - Proteus spp. (по 7,7 %) и Klebsiela spp. (15,4 % и 30,8 % соответственно) в количествах (p< 0,05) превышающих формально-нормативные (табл. 2). Количество банальных E.coli в исследуемых группах было снижено (p>0,05). При проведении сравнительного анализа по признаку частот обнаружения различных видов и / или родов микроорганизмов в фекалиях обследуемых значимые отличия регистрировали только для штаммов банальных E.coli, их количество в исследуемых группах было ниже (р>0,05) формально-нормативных, частота обнаружения которых была значимо выше (р=0,03) в III группе, по сравнению с аналогичными показателями в I и II группах. Только в фекалиях обследуемых II группы (7,7 %) верифицированы энтеропатогенные штаммы E.coli в количестве превышающим формально-нормативные. Только в III группе в фекалиях обнаружены (7,7 %) штаммы C. difficile. Был проведен сравнительный анализ средних значений (медиана) количественных показателей различных таксонов микробиоты толстой кишки не только с формально-нормативными, но и межгрупповой. Отличия обнаружены лишь для F. prausnitzii, количество которых было значимо меньше (р=0,02) в III группе по сравнению с I группой. Несмотря на выявленные различия в частоте обнаружения некоторых таксонов микроорганизмов в исследуемых группах при проведении иерархической кластеризации результатов по признаку частоты встречаемости значимая связь кластера с фактором «группа» не обнаружена (p=0,08) (рис. 1, табл. 3).
На дендрограмме визуализируются три кластера, в которых практически с равнозначной частотой входят обследуемые всех групп. Результаты дендрограммы подтверждены проведенным многофакторным анализом (статистика PERMANOVA:R2 =0,7191, p=0.3,9999 перестановок).
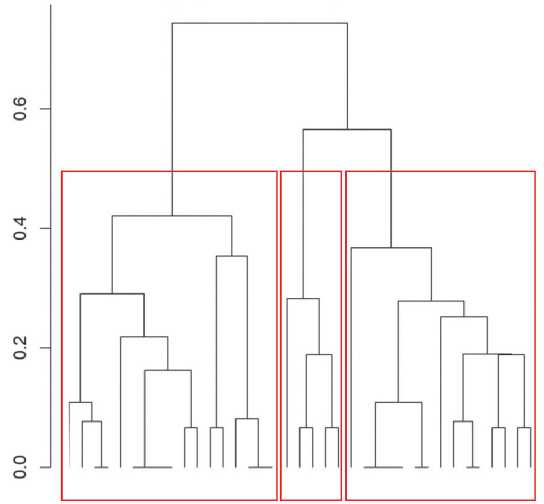
Рисунок 1. Иерархическая кластеризация результатов по встречаемости микроорганизмов толстой кишки.
Figure 1. Hierarchical clustering of results on the occurrence of colon microorganisms.
Примечание: Список листов (конечных точек) дендрограммы по порядку: 25,22,9,32,33,31,27,2,23,17,28,24,37,36,29,12,20,18,4,5,30,34, 35,19,11,6,7,8,16,3,26,13,14,1,10,15,21.
Note: List of dendrogram sheets (end points) in order: 25,22,9,32,33,31,27,2,23,17,28,24,37,36,29,12,20,18,4,5,30,34,35,19,11,6,7,8,16,3,26,13,14, 1,10,15,21
Таблица / Table 3
Характеристика кластеров
Characterization of clusters
Группа | Кластер 1 | Кластер 2 | Кластер 3 |
Group | Cluster 1 | Cluster 2 | Cluster 3 |
1 | 1,3,6,7,8,10,11 | 2,9 | 4,5 |
2 | 13,14,15,16,19,21 | 12,17,20, 22,23,24 | 18 |
3 | 26,35 | 25,27,28,29,31,32,33,36,37 | 30,34 |
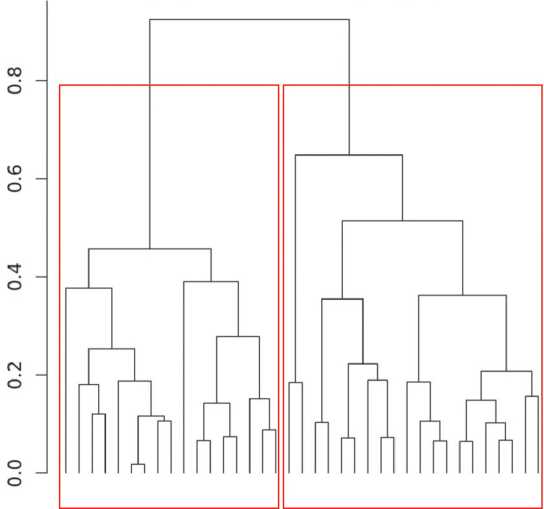
Рисунок 2. Иерархическая кластеризация результатов по концентрации микроорганизмов толстой кишки.
Figure 2. Hierarchical clustering of results on the concentration of microorganisms of the colon.
Примечание: Список листов (конечных точек) дендрограммы по порядку: 37, 17, 5, 10, 31, 8, 13, 7, 24, 12, 14, 15, 6, 26, 27, 28, 32, 34, 36, 22, 33, 2, 9, 23, 20, 25, 35, 3, 4, 11, 21, 30, 19, 16, 18, 1, 29.
Note: List of dendrogram sheets (end points) in order: 37, 17, 5, 10, 31, 8, 13, 7, 24, 12, 14, 15, 6, 26, 27, 28, 32, 34, 36, 22, 33, 2, 9, 23, 20, 25, 35, 3, 4, 11, 21, 30, 19, 16, 18, 1, 29.
Таблица / Table 4
Характеристика кластеров
Characterization of clusters
Группа | Кластер 1 | Кластер 2 |
Group | Cluster 1 | Cluster 2 |
1 | 1,3,5,8 | 2,4,6,7,9,10,11 |
2 | 13,16,17,18,19,21,23,24 | 12,14,15,20,22 |
3 | 25,28,29,30,31,36,37 | 26,27,32,33,34,35 |
Аналогичные результаты получены и при иерархической кластеризации результатов по признаку концентрации выделенных микроорганизмов (рис. 2, табл. 4).
Обсуждение
Количественные и качественные изменения в микробиоте толстой кишки могут являться триггером в развитии ожирения и метаболических нарушений [5]. Однако краеугольным камнем в интерпретации результатов микробиоты при различных фенотипах ожирения являются вопросы «нормы». Сравнивали количественные показатели микробиоты толстой кишки обследуемых с формально-нормативными, приведенными в стандарте «Колонофлор 16». У здоровых людей (I группа) были обнаружены значимые отличия, характеризующиеся снижением и повышением (p<0,05) некоторых таксонов микробиоты. Результаты исследований, в частности, проекта Human Microbiome Project (HMP) [7], основанные на индикации 16SpРНК бактерий убедительно доказали, что понятие «норма» зависит от множества факторов: возраста, этнической принадлежности, приема препаратов, различных групп в анализе и других факторов [7]. Поэтому полученные во II и III группах результаты сравнили не только с формальными показателями, но и с показателями I группы. Дискутабельным является вопрос отсутствия C.perfringens в фекалиях здоровых людей (если использовать для интерпритации набор «Колоноф- лор 16»). В отечественных и зарубежных учебниках по микробиологии [8,9] данный микроорганизм относят к основным представителям микрофлоры толстой кишки. Поэтому верификация данных таксонов в исследуемых группах является вариантом нормы. В пилотном исследовании было выявлено, что у обследуемых III группы существуют свои нюансы микробиоты толстой кишки, в частности, снижение количества F.prausnitzii по сравнению с аналогичными показателями в I и II группах, что находится в контексте с исследованиями E. Patterson (2016) et al. [10], R. Caesar (2015) et al. [11] и диссонирует с результатами F. Del Chierico (2018) et al. [12]. В III группе значимо повышена частота обнаружения банальных E.coli, по сравнению с аналогичными показателями в I и II группах. Необходимо отметить, что представители семейства Enterobacteriaceae, в частности E.coli, относят к группе факультативно-анаэробных грамотрицательных палочек и являются представителями симбионтной микробиоты [8,9]. Нарастание частоты обнаружения E.coli в III группе требует дальнейшего изучения, так как по данным R.B. Radilla-Vazquer et al. отсутствие в микробиоте толстой кишки E.coli было независимым предиктором увеличения ИМТ [13]. Только у обследуемых III группы в фекалиях регистрировали C. difficile. В данном пилотном исследовании нельзя ответить на вопрос: «Это случайная находка или, быть может, некий маркер изменения микробиоты толстой кишки при ожирении с метаболическим синдромом?». По данным современной литературы, пациенты с ожирением имеют меньшее бактериальное разнообразие, чем худые люди [13]. Однако настоящие данные, наоборот, выявили более низкое бактериальное разнообразие у здоровых худых обследуемых (I группа), а более разнообразный композиционный состав микробиоты толстой кишки — у пациентов с метаболически нездоровым ожирением (III группа).
Таким образом, полученные в результате пилотного исследования данные, безусловно, свидетельствуют об изменениях микробиоты толстой кишки у людей с ожирением и метаболическими нарушениями. Требуется дальнейшее изучение микробиоценоза толстой кишки у пациентов с различными типами ожирения, но уже с большим количеством обследуемых в группах.
Выводы
- У здоровых людей в микробиоте толстой кишки по сравнению с формально-нормативными показателями снижено (p<0,05) количество. Lactobacillusspp., Bifidobacteriumspp., B. thetaiotaomicron и повышены (p<0,05) показатели общей бактериальной массы, Enterobacterspp. / Citrobacterspp.
- У обследуемых с метаболически здоровым ожирением (IIгруппа) наблюдаются изменения микробиоты аналогичные 1 группе. Однако в отличие от I группы в фекалиях обнаружены Klebsiella spp. и Proteus spp. в количествах (p<0,05) превышающих формально-нормативные.
- У обследуемых с метаболически нездоровым ожирением помимо изменений, выявленных в I и II группах, в фекалиях обнаружены C.difficile, а также значимое (p<0,05) снижение F.prausnitzii и повышение (p<0,05) частот обнаружения банальных E.coli и Klebsiellaspp.
Финансирование. Исследование не имело спонсорской поддержки.
Financing. The study did not have sponsorship.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. Authors declares no conflict of interest.
Список литературы
1. Qasim A., Turcotte M., de Souza R.J., Samaan M.C., Champredon D., et al. On the origin of obesity: identifying the biological, environmental and cultural drivers of genetic risk among human populations. // Obes. Rev. - 2018. - V. 19(2). - Р.121-149. https://doi.org/10.1111/obr.12625
2. Meldrum D.R., Morris M.A., Gambone J.C. Obesity pandemic: causes, consequences, and solutions—but do we have the will? // Fertil Steril. - 2017.- V.107(4). - P.833-839. https://doi.org/10.1016/j.fertnstert.2017.02.104.
3. Goossens G.H. The Metabolic Phenotype in Obesity: Fat Mass, Body Fat Distribution, and Adipose Tissue Function. // Obes Facts. - 2017. - V.10(3). - P.207–215. https://doi.org/10.1159/000471488.
4. Волкова Н.И., Ганенко Л.А., Головин С.Н. Роль микробиоты кишечника в развитии ожирения и его метаболического профиля (часть II). // Медицинский вестник Северного Кавказа. - 2019. - Т.14(2). - С.391-396. https:// doi.org/10.14300/mnnc.2019.14098
5. Muscogiuri G., Cantone E., Cassarano S., Tuccinardi D., Barrea L. et al. Gut microbiota: a new path to treat obesity. // Int J Obes Suppl. - 2019. - V.9(1). - P.10-19. https://doi.org/10.1038/s41367-019-0011-7.
6. Phillips C.M. Metabolically healthy obesity across the life course: epidemiology, determinants and implications. // Ann N.Y. Acad Sci.- 2017. - V.139(1). - P.85-100. https://doi.org/10.1111/nyas.13230
7. Integrative HMP (iHMP) Research Network Consortium. Proctor L.M., Sechi S., DiGiacomo N.D., Fettweis J.M., et al. The Integrative Human Microbiome Project: dynamic analysis of microbiome-host omics profi les during periods of human health and disease. // Cell Host Microbe. - 2014.-V.16(3). - P-276-89. https://doi.org/10.1016/j.chom.2014.08.014.
8. Зверев В.В., Быков А.С. Медицинская микробиология, вирусология и иммунология. - М.: «МИА», 2016.
9. Murray P.R., Rosental K.S., Pfaller M.A. Medical Microbiology 8-th edition (United States of America) - Elsevier, 2016.
10. Patterson E., Ryan P.M., Cryan J.F., Dinan T.G., Ross R.P., et al. Gut microbiota, obesity and diabetes. // Postgraduate Medical Journal. - 2016. - V.92. - P.286-300. https://doi.org/10.1136/postgradmedj-2015-133285
11. Caesar R., Tremaroli V., Kovatcheva-Datchary P., Cani P.D., Bäckhed F. Crosstalk between gut microbiota and dietary lipids aggravates WAT infl ammation through TLR signaling. // Cell Metab. - 2015. - V.22. - P.658–68. https://doi.org/10.1016/j.cmet.2015.07.026
12. Chierico D., Abbatini F., Russo A., Quagliariello A., Reddel S., et al. Gut Microbiota Markers in Obese Adolescent and Adult Patients: Age-Dependent Diff erential Patterns. // Front Microbiol. - 2018. - V.9. - P.1210. https://doi.org/10.3389/fmicb.2018.01210
13. Radilla-Vázquez R.B., Parra-Rojas I., Martínez-Hernández N.E., Márquez-Sandoval Y.F., Illades-Aguiar B. et al. Gut Microbiota and Metabolic Endotoxemia in Young Obese Mexican Subjects. // Obes Facts. - 2016. - V.9(1). - P.1–11. https://doi.org/10.1159/000442479
Об авторах
Н. И. ВолковаРоссия
Волкова Наталья Ивановна, д.м.н., профессор, заведующая кафедрой внутренних болезней №3
Ростов-на-Дону
Ю. Л. Набока
Россия
Набока Юлия Лазаревна, д.м.н., профессор, заведующая кафедрой микробиологии и вирусологии №1
Ростов-на-Дону
Л. А. Ганенко
Россия
Ганенко Лилия Александровна, ассистент кафедры внутренних болезней №3
Ростов-на-Дону
О. С. Оксенюк
Россия
Оксенюк Оксана Станиславовна, к.м.н., руководитель центральной научно-исследовательской лаборатории
Ростов-на-Дону
Рецензия
Для цитирования:
Волкова Н.И., Набока Ю.Л., Ганенко Л.А., Оксенюк О.С. Особенность микробиоты толстой кишки у пациентов с разными фенотипами ожирения (пилотное исследование). Медицинский вестник Юга России. 2020;11(2):38-45. https://doi.org/10.21886/2219-8075-2020-11-2-38-45
For citation:
Volkova N.I., Naboka Y.L., Ganenko L.A., Оksenuk O.S. A feature of the microbiota of the colon in patients with different phenotypes of obesity (pilot study). Medical Herald of the South of Russia. 2020;11(2):38-45. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-2-38-45







































