Перейти к:
Роль цитокинов в ремоделировании костной ткани и патогенезе постменопаузального остеопороза
https://doi.org/10.21886/2219-8075-2020-11-2-6-18
Аннотация
Около 20 лет назад была обозначена новая область научных знаний – остеоиммунология, которая изучает закономерности взаимодействия иммунной и костной систем в норме и патологии. Достижения остеоиммунологии кардинально изменили наши представления о патогенезе заболеваний скелета человека, в том числе остеопороза. В настоящем обзоре литературы представлена ключевая роль цитокинов в процессах ремоделирования костной ткани в физиологических и патологических условиях. Подробно освещены вопросы взаимодействия посредством цитокинов остеобластов и остеокластов в процессе ремоделирования костной ткани. Охарактеризовано решающее значение увеличенной продукции провоспалительных цитокинов иммунокомпетентными клетками в развитии постменопаузального остеопороза. При подготовке статьи осуществлялся системный поиск литературы по базам данных Pubmed, Scopus, Web of Science, MedLine, eLIBRARY.RU и др.
Для цитирования:
Игнатенко Г.А., Немсадзе И.Г., Мирович Е.Д., Чурилов А.В., Майлян Э.А., Глазков А.Э., Румянцева З.С. Роль цитокинов в ремоделировании костной ткани и патогенезе постменопаузального остеопороза. Медицинский вестник Юга России. 2020;11(2):6-18. https://doi.org/10.21886/2219-8075-2020-11-2-6-18
For citation:
Ignatenko G.A., Nemsadze I.G., Mirovich E.D., Churilov A.V., Maylyan E.A., Glazkov I.S., Rumyantceva Z.S. The role of cytokines in bone remodeling and the pathogenesis of postmenopausal osteoporosis. Medical Herald of the South of Russia. 2020;11(2):6-18. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-2-6-18
Введение
Вначале 70-х гг. прошлого столетия появились первые доказательства наличия тесной связи между иммунной системой и костной тканью. J.E. Horton и соавт. [1] продемонстрировали в своих новаторских исследованиях способность иммунокомпетентных клеток выделять факторы, которые стимулируют функцию остеокластов и приводят к усилению резорбции кости. В 1990-х гг. была установлена ключевая роль в регуляции остеокластов и в ремоделировании костной ткани цитокиновой системы RANKL/RANK/OPG [2]. В 2000 г. американские ученые J.R. Arron и Y. Choi [3] предложили термин «Остеоиммунология». И этим термином была обозначена новая область научных знаний, которая изучает закономерности взаимодействия иммунной и костной систем организма в норме и патологии.
Бурное развитие и существенные успехи остеоиммунологии позволили выделить важную роль иммунных факторов в патологии костной системы и существенно пересмотреть представления о механизмах развития различных заболеваний скелета, в том числе остеопороза. В последние годы, благодаря доказательствам ключевой роли иммунных механизмов, остеопороз стали называть хроническим иммуноопосредованным заболеванием [4,5]. А в 2018 г., учитывая важнейший вклад иммунной системы в патогенез остеопороза, R.K. Srivastava и соавт. [6] научно обоснованно ввели термин «Иммунопороз».
В настоящее время уже не вызывает сомнений то, что участие иммунных механизмов в патогенезе костной патологии не менее актуально, чем при инфекционных и аутоиммунных заболеваниях, аллергии. Более того, остеоиммунология бурно развивается, с каждым годом демонстрируя новые сведения о патогенезе заболеваний скелета и открывая новые перспективы для профилактики и лечения такой широко распространенной патологии человека как остеопороз. С целью отражения уже достигнутых успехов в области остеоиммунологии и исследовании роли цитокинов в патогенезе остеопороза, для обоснования необходимости дальнейшего научного поиска в этом направлении, в том числе разработки прикладных решений, и подготовлен данный обзор литературы.
Цитокины в регуляции дифференцировки остеобластов
Остеобласты (ОБ) происходят из мезенхимальных стволовых клеток. Мезенхимальные стволовые клетки расположены в костном мозге и способны созревать в различные типы клеточных элементов, в частности в хондроциты, адипоциты и ОБ [7]. Дифференцировка их именно в ОБ обусловлена высокоспецифичным сочетанием комплекса факторов, основные из которых представлены на рис. 1.
Точный перечень факторов, участвующих в созревании ОБ, окончательно не определен [8,9]. Не до конца изучена и биологическая роль каждого из них. Однако уже сейчас ясно, что в дифференцировку ОБ большой вклад вносят иммунные факторы. Так, показано, что убТ лимфоциты ускоряют пролиферацию и дифференцировку ОБ путем усиления секреции интерлейкина (IL)-17A [10]. Макрофаги подавляют активность линии остеобластных клеток путем продукции фактора некроза опухолей альфа (TNF-α) и макрофагального воспалительного белка 1-α (CCL-3), которые являются мощными ингибиторами дифференцировки вышеуказанных клеток [11]. Угнетается процесс образование ОБ цитокином IL-3, а также повышенными уровнями глюкокортикоидных гормонов [12].
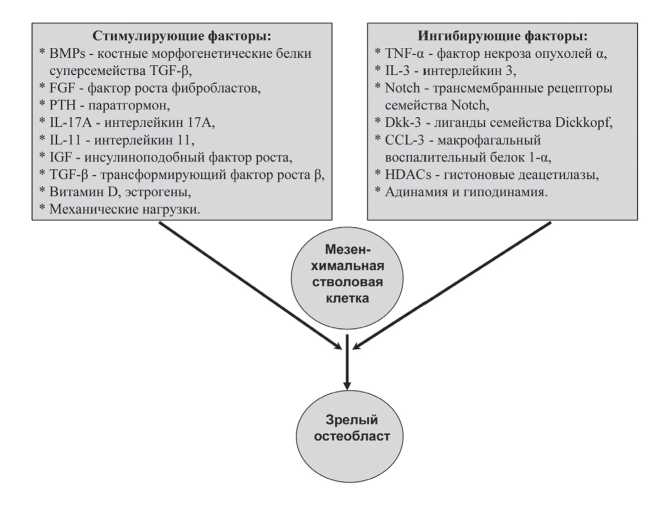
Рисунок 1. Основные факторы в регуляции дифференцировки остеобластов.
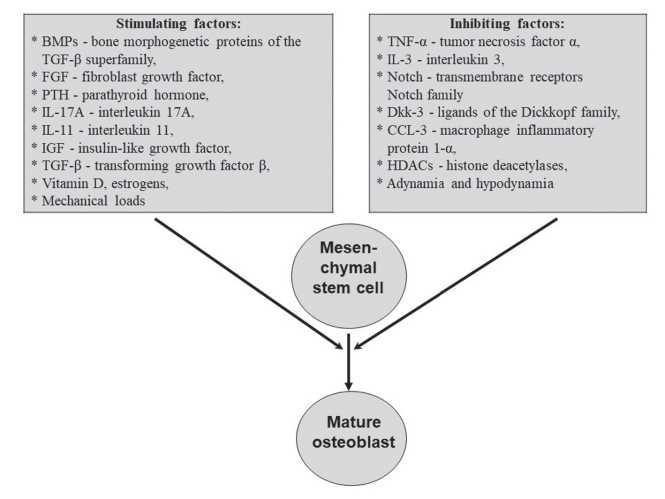
Figure 1. The main factors in osteoblast differentiation regulation.
Положительное влияние на развитие ОБ оказывают такие цитокины как трансформирующий фактор роста в β (TGF-β), костные морфогенетические белки суперсемейства TGF-β (BMPs), инсулиноподобный фактор роста (IGF), фактор роста фибробластов (FGF), IL-11. Недавно выполненными исследованиями было показано участие в процессе дифференцировки ОБ противовоспалительного цитокина IL-10 [13]. IL-10 был идентифицирован как важный цитокин, который усиливает остеобластогенез.
Витамин D и эстрогены также являются важными факторами, оказывающими стимулирующее действие на ОБ и образование кости в целом [14,15]. При этом следует учитывать, что дефицит витамина D и женских половых гормонов сопровождается ослаблением не только прямых их эффектов на костные клетки. Более важным в патогенезе остеопороза считается то, что снижение концентраций вышеуказанных гуморальных факторов обусловливает изменения в иммунной системе. Эти изменения характеризуются повышенной секрецией ряда провоспалительных цитокинов (IL-1, IL-6, IL-17 и др.), которые в конечном итоге и приводят к усилению резорбции костной ткани [16].
Цитокины в регуляции ремоделирования костной ткани в физиологических условиях
Процесс ремоделирования кости в физиологических условиях требует постоянного и активного взаимодействия трех основных типов клеток — остеоцитов, ОБ и остеокластов (ОК). Этими клетками обеспечивается эффективная регуляция остеобластогенеза, остеокластогенеза и ангиогенеза, вследствие чего костная ткань, постоянно обновляясь, сохраняет свою структуру и свойства [17,18]. Установлено, что взаимодействие между ОБ и ОК может осуществляться посредством прямого контакта или через внеклеточные везикулы [19]. При этом передача информации между клетками происходит путем обмена молекулами низкой молекулярной массы, в том числе цитокинами [2].
Следует отметить, что молекулярные механизмы клеточной коммуникации между ОБ и ОК являются одними из наиболее важных в биологии костных клеток и ремоделировании кости в физиологических условиях. Причем, взаимосвязь между вышеуказанными клетками осуществляется на различных стадиях их дифференцировки. При этом центральное внимание уделяется ОБ, которым отводится ключевая роль в обеспечении созревания ОК, контроле их активности и регуляции ремоделирования кости в целом. В последние годы появляется все больше доказательств и сильных обратных связей, посредством которых ОК влияют на созревание и активность ОБ [20,21].
И именно от перекрестных связей между остеобластами и остеокластами зависит гомеостаз кости и процессы ее ремоделирования в физиологических условиях. А взаимодействие и кооперация ОБ и ОК, обеспечение их функционального баланса обусловливается многими цитокинами, гормонами и сигнальными путями.
Регуляция остеобластами функции ОК осуществляется благодаря их способности секретировать ряд гуморальных факторов [2,17], основными из которых являются следующие:
- макрофагальный колониестимулирующий фактор (M-CSF, цитокин) — стимулирует остеокластогенез;
- лиганд активатора рецептора ядерного фактора кВ (RANKL, цитокин суперсемейства TNF) — стимулирует остеокластогенез;
- остеопротегерин (OPG, цитокин суперсемейства TNF) — ингибирует остеокластогенез;
- моноцитарный хемоаттрактантный белок-1 (MCP- 1, цитокин) — стимулирует остеокластогенез;
- семафорин 3A (SEMA3A) — ингибирует остеокластогенез;
- лизофосфатидная кислота (LPA) — стимулирует остеокластогенез;
- лиганд к рецептору апоптоза Fas (FasL, цитокин суперсемейства TNF) — вызывает апоптоз остеокластов.
Остеоциты являются источником склеростина (SOST), который обладает выраженным ингибирующим действием на дифференцировку ОБ благодаря свойству блокировать WNT-сигнальный путь [22]. Необходимо отметить, что и ОК в определенных условиях также способны синтезировать SOST и тем самым уменьшать костеобразующий потенциал ОБ [23].
Кроме того, ОК продуцируют такие мощные ингибиторы остеобластогенеза, как белок Atp6v0d2 и семафорин 4D (Sema4D). Синтезируемые же остеокластами С3a и С5а компоненты комплемента, наоборот, стимулирует дифференцировку ОБ [20, 24]. Результаты нескольких последних исследований подчеркивают остеоанаболический потенциал и сфингозин-1-фосфата (S1P). S1P идентифицируется как ключевой мессенджер (система обмена мгновенными сообщениями), связанный с ОК и локально повышающий костеобразующую способность ОБ [25]. Молекулы SLIT3 (Slit guidance ligand 3 — щелевой направляющий лиганд 3), которые продуцируются остеокластами, усиливают миграцию и пролиферацию ОБ путем активации β-катенина и в то же время подавляют остеокластогенез аутокринным путем [26].
Кроме того, ОК секретируют костный морфогенетический белок BMP6, CTHRC1 (rallagen triple helix repeat containing 1), EFNB2 (еphrin-B2 protein), WNT10B (белок WNT-сигнального пути), CT-1 (кардиотропин-1, цитокин), которые участвуют в регуляции ОБ и остеоцитов и тем самым влияют на остеогенез [27].
Каждый из вышеуказанных гуморальных факторов играет важную роль во взаимодействиях ОБ и ОК. Однако ключевое значение в регуляции ремоделирования костной ткани и в остеокластогенезе отводят двум цитокинам [28]. Обязательным условием для образования зрелых ОК является воздействие на их предшественников M-CSF и RANKL (рис. 2).
Образование комплекса M-CSF с рецептором C-fms на предшественниках ОК является необходимым условием для ранней стадии дифференциации вышеуказанных клеток. M-CSF стимулирует экспрессию в ОК молекул RANK (активатор рецептора ядерного фактора кВ) и повышает пролиферативную активность ОК. Кроме того, M-CSF увеличивает жизнеспособность ОК благодаря способности ингибировать их апоптоз.
Молекулы RANKL относятся к цитокиновой системе RANK/RANKL/OPG, которая выполняет ключевую роль в активации NF-кВ-сигнального пути и регуляции остеокластогенеза [30]. А нарушения в этой системе являются ведущими в патогенезе постменопаузального ОП [31].
RANKL связывается с рецептором RANK на предшественниках или зрелых ОК [9,18,31-34]. Воздействие образующегося при этом комплекса RANKL-RANK на клетки осуществляется через ряд факторов транскрипции с участием TRAF6 (фактора 6, ассоциированного с рецептором фактора некроза опухолей, TNF receptor-associated factor 6), NF-kB, с-Fos, фосфолипазы Cy (PLCy), транскрипционного фактора NFATc1 (ядерный фактор активированных Т-клеток c1). В итоге образование комплекса RANKL-RANK приводит к повышенной экспрессии генов TRAP (тартрат-устойчивая кислая фосфатаза), катепсина К, интегрина β3, остеокласт-ассоциированного рецептора (OSCAR) и других генов, необходимых для образования активных ОК и обеспечения их функции.
Важным третьим компонентом системы RANKL/ RANK/OPG является остеопротегерин (OPG), который также относится к цитокинам суперсемейства TNF. OPG обеспечивает протективную роль в отношении резорбции костной ткани и активации ОК, являясь растворимым «рецептором-ловушкой» для RANKL [31,35]. В итоге степень активации ОК определяется количественным соотношением продукции молекул RANKL и OPG. В отсутствие патологии соотношение OPG/RANKL находится в определенном равновесии. При остеопорозе соотношение нарушается в сторону превалирования уровней RANKL. Моногочисленные эксперименты на животных демонстрируют, что сверхэкспрессия OPG приводит к увеличению плотности костной ткани — остеопетрозу, — а сниженная продукция вышеуказанных молекул — к остеопорозу. Необходимо отметить, что экспрессия OPG в ОБ регулируется рядом гормонов, цитокинов и факторов роста, среди которых важное значение имеют эстрогены, витамин D и TNF.

Рисунок 2. Центральная роль лиганда активатора рецептора ядерного фактора кВ (RANKL) и макрофагального колониестимулирующего фактора (M-CSF) в дифференцировке и регуляции активности остеокластов в физиологических условиях (адаптировано по M.N. Weitzmann, 2006 [29]).

Figure 2. The central role of receptor activator of nuclear factor kappa-B ligand (RANKL) and macrophage colony stimulating factor (M-CSF) in differentiation and regulation of osteoclast activity under physiological conditions (adapted from M.N. Weitzmann,2006 [29]).
Примечание: RANK — активатор рецептора ядерного фактора кВ; C-fms — специфический рецептор для M-CSF.
Note: RANK — receptor activator of nuclear factor кВ; C-fms — specific receptor for M-CSF.
Как было ранее указано, в физиологических условиях источником важных для остеокластогенза цитокинов M-CSF, RANKL и OPG являются главным образом зрелые ОБ и остеоциты, в меньшей степени — предшественники ОБ, мезенхимальные стромальные клетки. В связи с этим в норме именно эти клетки играют решающую роль в регуляции дифференцировки предшественников ОК и в обеспечении контроля активности уже зрелых ОК. Поэтому в значительной степени регуляция ремоделирования костной ткани в физиологических условиях ограничивается системой «Остеоцит-ОБ-ОК». Цитокиновой же системе RANKL-RANK-OPG отводят при этом ключевое значение во взаимодействиях ОБ и ОК, а также в остеокластогенезе.
Цитокины и нарушение костного ремоделирования при остеопорозе
Система RANKL/RANK/OPG играет важную роль не только в остеокластогенезе, но и в развитии и функционировании иммунных органов человека, в том числе лимфатических узлов, тимуса, костного мозга, селезенки, а также в регуляции иммунного ответа [31, 36, 37]. А экспрессия RANKL свойственна не только ОБ. Выраженная продукция цитокина RANKL отмечена и иммунокомпетентными клетками — активированными Т-лимфоцитами, В-лимфоцитами, моноцитами, макрофагами и др. У В-клеток обнаружено свойство секретировать и OPG. На B-лимфоциты приходится 64 % от общего производства OPG в костном мозге [38].
При этом необходимо учитывать, что в физиологических условиях роль иммунокомпетентных клеток в активации остеокластогенеза и стимуляции резорбции кости несущественна [39]. Однако при патологических состояниях, обусловленных рядом аутоиммунных и воспалительных заболеваний, эндокринными нарушениями, в том числе дефицитом эстрогенов в постменопаузе и т.д., и сопровождающихся активацией иммунной реактивности, происходит выраженное увеличение продукции различными типами иммунокомпетентных клеток молекул RANKL (рис. 3). Вследствие этого потенцируется остеокластогенез, повышается активность ОК и усиливается резорбция кости.

Рисунок 3. Продукция лиганда активатора рецептора ядерного фактора кВ (RANKL) в норме и патологии (адаптировано по S.M. Jung и соавт., 2014 [39]).

Figure 3. Expression of receptor activator of nuclear factor kappa-B ligand (RANKL) in normal and pathological conditions (adapted from S.M. Jung et al., 2014 [39]).
Примечание: ФПС — фибробластоподобные синовиоциты.
Note: ФПС — fibroblast-like synoviocytes (FPS).
Кроме того, активация иммунных клеток, которая может быть обусловлена у женщин в постменопаузе недостаточностью эстрогенов, приводит к увеличению продукции не только RANKL, но и других провоспалительных цитокинов [37,40,41]. И это представляется даже более важным в патогенезе постменопаузального остеопороза. Именно таким провоспалительным цитокинам как IL-1, IL-6, IL-7, IL-17, TNF отводят роль основных медиаторов ускоренной потери костной массы у женщин в постменопаузе. Результаты многочисленных научных работ, проведенных в экспериментах in vitro и in vivo, в том числе на моделях животных, доказали, что IL-1, IL-6, IL-7, IL-17, TNF, M-CSF и ряд других цитокинов иммунокомпетентных клеток (Т- и В-лимфоциты, натуральные киллеры, моноциты/макрофаги и др.) способны усиливать остеокластогенез и потенцировать резорбцию костной ткани [42]. Основные цитокины, участвующие в ремоделировании кости, и их эффекты [4,6,9,31,32,39,42,43] представлены ниже:
- IL-1. Прорезорбтивный эффект стимулирует созревание остеокластов RANKL-независимым путем посредством стимуляции экспрессии TRAF6, NF-kB-сигнального пути; в синергизме с RANKL усиливает дифференцировку ОК; увеличивает секрецию RANKL стромальными клетками и ОБ; опосредует вызванный TNF-α остеокластогенез; увеличивает экспрессию прорезорбтивного простагландина E2; является важным медиатором постменопаузального остеопороза.
- IL-4. Антирезорбтивный эффект ингибирует RANKL-зависимый и TNF-α-зависимый остеокластогенез; ингибирует эффект IL-1 и экспрессию c-Fos и NFATc1; снижает экспрессию RANKL; стимулирует образование OPG. Прорезорбтивный эффект индуцирует экспрессию TNF-α макрофагами посредством IL-6; увеличивает синтез ИЛ-1.
- IL-6. Прорезорбтивный эффект стимулирует выработку RANKL стромальными клетками; индуцирует RANKL-зависимый остеокластогенез; обладает синергизмом при совместном действии с IL-1, TNF-α и простагландинами в остеокластогенезе; ингибирует дифференцировку ОБ; индуцирует генерализованное воспаление; является важным медиатором постменопаузального остеопороза. Антирезорбтивный эффект подавляет дифференцировку ранних клеток-предшественников ОК и уменьшает образование ОК; подавляет канал сигнализации RANK; индуцирует образование OPG.
- IL-7. Прорезорбтивный эффект стимулирует пролиферацию и дифференцировку Т-лимфоцитов; активирует T и B-клетки; усиливает продукцию RANKL и других остеокластогенных цитокинов Т-клетками; обладает синергизмом при совместном действии с IL-1, TNF-α и IFN-γ в остеокластогенезе. Антирезорбтивный эффект угнетает остеокластогенез прямым действием на ОК.
- IL-8. Прорезорбтивный эффект увеличивает продукцию RANKL. Антирезорбтивный эффект увеличивает образование оксида азота.
- IL-10. Антирезорбтивный эффект стимулирует созревание ОБ, увеличивает образование оксида азота; усиливает выработку OPG; ингибирует экспрессию RANKL; ингибирует NF-kB-сигнальный путь; стимулирует противовоспалительную диф- ференцировку клеток Th1; ингибирует выработку провоспалительных и проостеокластогенных цитокинов. Прорезорбтивный эффект в синергизме с IL-4 увеличивает экспрессию TNF-α.
- IL-11. Прорезорбтивный эффект увеличивает соотношение RANKL/OPG. Антирезорбтивный эффект: действует как антагонист IL-6.
- IL-12. Прорезорбтивный эффект индуцирует выработку ИЛ-1 и цитокинов клетками Th1. Антирезорбтивный эффект подавляет индуцированный Т-клетками остеокластогенез; обладает прямым ингибирующим действием на ОК; обладает синергизмом при совместном действии с IFN-γ и IL-18.
- IL-13. Прорезорбтивный эффект ингибирует активность ОБ и минерализацию кости. Антирезорбтивный эффект: подавляет активность ОК.
- IL-15. Прорезорбтивный эффект усиливает диф- ференцировку ОК; обладает синергизмом при совместном действии с TNF-α.
- IL-17. Прорезорбтивный эффект повышает продукцию RANKL остеобластами, синовиальными клетками и фибробластами; повышает чувствительность ОК к RANKL; усиливает синтез матриксных металлопротеиназ — ММР; индуцирует экспрессию провоспалительных цитокинов TNF-α, IL-1, IL-6, IL8 и др.; усиливает остеокластогенез через стимуляцию продукции простагландина Е2 остеобластами; обладает синергизмом при совместном действии с TNF-α, IL-1 и простаглан- динами в остеокластогенезе; является важным медиатором постменопаузального остеопороза. Антирезорбтивный эффект подавляет образование ОК при высоких концентрациях; ингибирует остеокластогенез путем индукции GM-CSF.
- IL-18. Антирезорбтивный эффект повышает продукцию OPG стромальными клетками, GM-CSF и IFN-γ Т клетками; ингибирует RANKL/RANK-сигнализацию.
- IL-23. Прорезорбтивный эффект увеличивает пул предшественников ОК; увеличивает популяцию клеток Th17; стимулирует продукцию IL-17 и RANKL; активирует ОК при воспалительных процессах. Антирезорбтивный эффект ингибирует созревание предшественников ОК и активность зрелых ОК в физиологических условиях; обладает синергизмом при совместном действии с IL-18 в ингибировании остеокластогенеза.
- IL-27. Антирезорбтивный эффект блокирует NF- кВ-сигнальный путь — RANK-зависимый остеокластогенез; ингибирует образование ОК.
- IL-31. Прорезорбтивный эффект стимулирует продукцию провоспалительных цитокинов TNF-α, IL-1β, IL-8, хемокинов и матриксных металлопротеиназ (ММР).
- IL-32. Прорезорбтивный эффект стимулирует продукцию провоспалительных цитокинов; индуцирует дифференцировку предшественников ОК. Антирезорбтивный эффект ингибирует созревание ОК.
- IL-33. Прорезорбтивный эффект стимулирует экспрессию TNF-α; обладает синергизмом при совместном действии с IL-6 в усилении резорбции кости. Антирезорбтивный эффект обладает синергизмом при совместном действии с IL-4 в ингибировании активности предшественников остеокластов и остеокластов.
- TNF-α. Прорезорбтивный эффект стимулирует продукцию RANKL, M-CSF и с-Fms на остеокластах; независимо от RANKL или в синергизме с RANKL усиливает дифференцировку ОК; активирует в ОК транскрипционные факторы TRAF2, NF-kB; ингибирует апоптоз ОК; ингибирует созревание предшественников ОБ и активность ОБ; индуцирует апоптоз ОБ; ингибирует Wnt-сигнальный путь; подавляет активность генов щелочной фосфатазы, рецептора витамина D, рецептора паратгормона, участвующих в формировании костей; является важным медиатором постменопаузального остеопороза.
- TGF-p. Прорезорбтивный эффект стимулирует RANKL-зависимый остеокластогенез. Антирезорбтивный эффект подавляет процесс активации Т-клеток; подавляет эффекты провоспалительных цитокинов; стимулирует апоптоз ОК; стимулирует дифференцировку и миграцию предшественников ОБ; потенцирует продукцию остеобластами OPG.
- INF-γ. Прорезорбтивный эффект стимулирует экспрессию антигенов главного комплекса гистосовместимости II класса на антиген-представляющих клетках; усиливает презентацию антигена и активирует Т-клетки; повышает продукцию остеокластогенных цитокинов. Антирезорбтивный эффект снижает продукцию катепсина K остеокластами; подавляет остеокластогенез, опосредованный паратиреоидным гормоном и IL-1; действует как антагонист TNF-α.
- M-CSF. Прорезорбтивный эффект регулирует экспрессию RANK предшественниками ОК; стимулирует дифференцировку клеток моноцитарно-макрофагальной линии; увеличивает пул предшественников ОК; в синергизме с RANKL участвует в образовании зрелых ОК.
Важно отметить, что вышеуказанные провоспалительные цитокины в силу своих биологических свойств как напрямую могут оказывать стимулирующее воздействие на остеокластогенез, в том числе RANKL- независимым путем [44], так и опосредованно — путем индукции синтеза друг друга, а также потенцируя экспрессию RANKL. Причем, наиболее мощные резорбтивные эффекты характерны для TNF-α, IL-1, IL-6 и IL-17. В связи с этим указанные цитокины получили название проостеокластогенных и были отнесены к наиболее значимым медиаторам постменопаузального остеопороза.
Следует указать, что среди клеток иммунной системы ключевую роль в нарушениях регуляции ремоделирования кости отводят Т-лимфоцитам [4,6]. Снижение продукции эстрогенов у женщин в постменопаузальном периоде сопровождается активацией вышеуказанных клеток и ростом секреции ими как провоспалительных, так и противовоспалительных цитокинов (рис. 4). Конечный эффект Т лимфоцитов на костную ткань зависит от количественных и функциональных соотношений различных их популяций, фенотипов (CD4+ или CD8+, Th1, Th2, Treg или Th17 и т.д.) и, конечно же, от интенсивности продукции ими тех или иных цитокинов.
Заключение
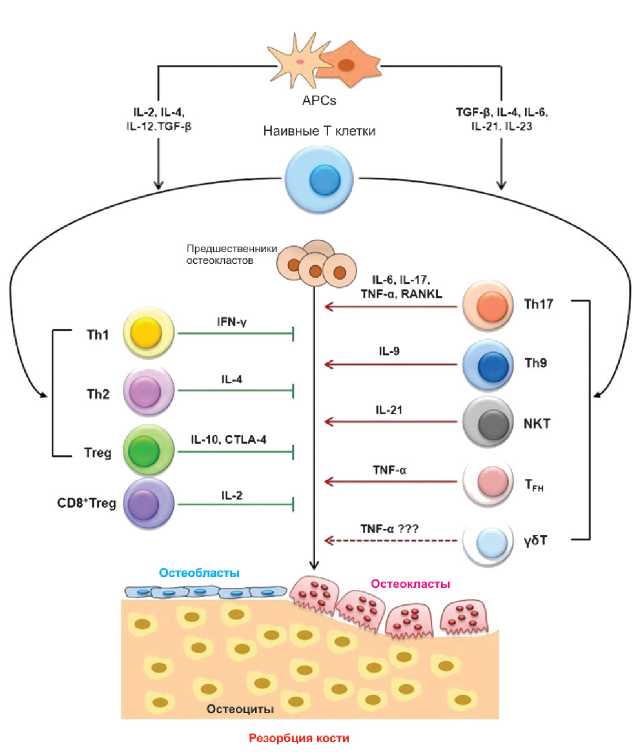
Рисунок 4. Роль Т лимфоцитов и их цитокинов в регуляции остеокластогенеза (адаптировано по R.K. Srivastava и соавт., 2018 [6]).
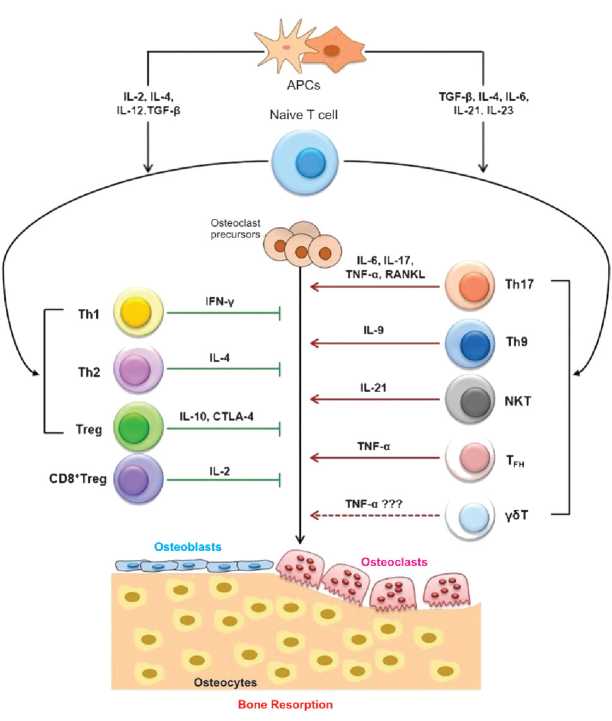
Figure 4. The role of T lymphocytes and their cytokines in osteoclastogenesis regulation (adapted from R.K. Srivastava et al., 2018 [6]).
Примечание: APCs — антиген-представляющие клетки; IL — интерлейкин; TGF-β — трансформирующий ростовой фактор бета; Th1, Th2, Th9, Th17 — Т хелперы 1, 2, 9 и 17 типов; Treg — Т лимфоциты регуляторные; CD8+Treg — регуляторные Т цитотоксические лимфоциты; NKT — натуральные киллерные Т клетки; TFH — фолликулярные Т хелперы; γ5T - γбТ лимфоциты; INF-γ — интерферон гамма; TNF-α — фактор некроза опухолей альфа; RANKL — лиганд активатора рецептора ядерного фактора кВ; CTLA-4 — ассоциированный с цитотоксическими Т лимфоцитами протеин 4.
Note: APCs — antigen-presenting cells; IL - interleukin; TGF-β — transforming growth factor beta; Th1, Th2, Th9, Th17 — T helpers of types 1, 2, 9 and 17; Treg — T lymphocytes regulatory; CD8+ Treg — regulatory T cytotoxic lymphocytes; NKT — natural killer T cells; TFH — follicular T helpers; γST — yST lymphocytes; INF-γ — interferon gamma; TNF-α — tumor necrosis factor alpha; RANKL — receptor activator of nuclear factor kB ligand; CTLA-4 — protein 4 associated with cytotoxic T lymphocytes.
Таким образом, результаты проведенных в последние годы исследований существенно расширили представления о роли цитокинов в ремоделировании костной ткани и патогенезе остеопороза. На данный момент на клеточном и молекулярном уровнях доказана ключевая роль иммунных факторов в развитии остеопоротических нарушений костной ткани, в том числе при постменопаузальном остеопорозе. Накопленные за последние годы данные о роли иммунных механизмов в патогенезе заболеваний костной системы имеют важную научную ценность и частично применяются в практической медицине. Уже сейчас есть научно обоснованные предпосылки и для дальнейшего более широкого использования результатов научных изысканий при разработке новых подходов в профилактике и терапии постменопаузального остеопороза, в том числе исходя из того, что остеопороз у женщин в постменопаузе является хроническим воспалительным заболеванием, а центральное значение в его патогенезе имеет степень активации иммунокомпетентных клеток и уровень экспрессии ими провоспалительных и противовоспалительных цитокинов. При этом в качестве фармакологических мишеней в будущих терапевтических стратегиях по предотвращению потери костной массы и переломов могут быть как сами клеточные источники вышеуказанных медиаторов, так и непосредственно те или иные цитокины. Однако далеко не все аспекты остеоиммунологии изучены достаточно полно. В ряде случаев полученные результаты являются неоднозначными, спорными или не до конца решенными. Поэтому требуются дальнейшие исследования для более глубокого понимания механизмов регуляции костного ремоделирования иммунными факторами в норме и патологии.
Финансирование. Исследование не имело спонсорской поддержки.
Finansing. The study did not have sponsorship.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. Authors declares no conflict of interest.
Список литературы
1. Horton J.E., Raisz L.G., Simmons H.A., Oppenheim J.J., Mergenhagen S.E. Bone resorbing activity in supernatant fl uid from cultured human peripheral blood leukocytes // Science. – 1972. – V.177. – P.793-795. https://doi.org/10.1126/science.177.4051.793
2. Chen X., Wang Z., Duan N., Zhu G., Schwarz E.M., Xie C. Osteoblast-osteoclast interactions // Connect Tissue Res. – 2018. – V.59, №2. – Р.99-107. https://doi.org/10.1080/03008207.2017.1290085
3. Arron J.R., Choi Y. Bone versus immune system // Nature. – 2000. – V.408. – Р.535-536. https://doi.org/10.1038/35046196
4. Ginaldi L., De Martinis M. Osteoimmunology and Beyond // Curr. Med. Chem. – 2016. – V.23, №33. – Р.3754-3774. https://doi.org/10.2174/0929867323666160907162546
5. Liu H., Luo T., Tan J., Li M., Guo J. Osteoimmunology’ Offers New Perspectives for the Treatment of Pathological Bone Loss // Curr Pharm Des. – 2017. – V.23, №41. – Р. 6272-6278. https://doi.org/10.2174/1381612823666170511124459
6. Srivastava R.K., Dar H.Y., Mishra P.K. Immunoporosis: Immunology of Osteoporosis-Role of T Cells // Front Immunol. – 2018. – V.9. – Р.657. https://doi.org/10.3389/fimmu.2018.00657
7. Hu L., Yin C., Zhao F., Ali A., Ma J., Qian A. Mesenchymal Stem Cells: Cell Fate Decision to Osteoblast or Adipocyte and Application in Osteoporosis Treatment // Int J Mol Sci. – 2018. – V.19, №2. – Р.360. https://doi.org/10.3390/ijms19020360
8. Chen Q., Shou P., Zheng C., Jiang M., Cao G. et al. Fate decision of mesenchymal stem cells: adipocytes or osteoblasts? // Cell Death Diff er. – 2016. – V.23, №7. – P.1128-1139. https://doi.org/10.1038/cdd.2015.168
9. Guder C., Gravius S., Burger C., Wirtz D.C., Schildberg F.A. Osteoimmunology: A Current Update of the Interplay Between Bone and the Immune System // Front Immunol. – 2020. – V.11. – P.58. https://doi.org/10.3389/fimmu.2020.00058
10. Ono T., Takayanagi H. Osteoimmunology in bone fracture healing // Curr Osteoporos Rep. – 2017. – V.15, №4. – P.367-375. https://doi.org/10.1007/s11914-017-0381-0
11. Gong L., Zhao Y., Zhang Y., Ruan Z. The macrophage polarization regulates MSC osteoblast differentiation in vitro // Ann Clin Lab Sci. – 2016. – V.46, №1. – P.65-71. PMID: 26927345
12. Han L., Wang B., Wang R., Gong S., Chen G., Xu W. The shift in the balance between osteoblastogenesis and adipogenesis of mesenchymal stem cells mediated by glucocorticoid receptor // Stem Cell Res Ther. – 2019. – V.10, №1. – P.377. https://doi.org/10.1186/s13287-019-1498-0
13. Vallés G., Bensiamar F., Maestro-Paramio L., García-Rey E., Vilaboa N., Saldaña L. Influence of inflammatory conditions provided by macrophages on osteogenic ability of mesenchymal stem cells // Stem Cell Res Ther. – 2020. – V.11, №1. – P.57. https://doi.org/10.1186/s13287-020-1578-1
14. Поворознюк В.В., Резниченко Н.А., Майлян Э.А. Регуляция эстрогенами ремоделирования костной ткани // Репродуктивная эндокринология. – 2014. – T.15, №1. – С.14-18.
15. Майлян Э.А. Регуляция витамином D метаболизма костной ткани // Медицинский вестник Юга России. – 2017. – T.8, №1. – C.12-20. https://doi.org/10.21886/2219-8075-2017-1-12-20
16. Майлян Э.А. Современные представления об этиологии и патогенезе постменопаузального остеопороза // Проблемы остеологии. – 2015. – T.18, №2. – С.3-11.
17. Han Y., You X., Xing W., Zhang Z., Zou W. Paracrine and endocrine actions of bone-the functions of secretory proteins from osteoblasts, osteocytes, and osteoclasts // Bone Res. – 2018. – №6. – P.16. https://doi.org/10.1038/s41413-018-0019-6
18. Kenkre J.S., Bassett J. The bone remodelling cycle // Ann Clin Biochem. – 2018. – V.55, №3. – P. 308-327. https://doi.org/10.1177/0004563218759371
19. Yuan F.L., Wu Q.Y., Miao Z.N., Xu M.H., Xu R.S. et al. Osteoclast-Derived Extracellular Vesicles: Novel Regulators of Osteoclastogenesis and Osteoclast-Osteoblasts Communication in Bone Remodeling // Front Physiol. – 2018 . – V.9. – P.628. https://doi.org/10.3389/fphys.2018.00628
20. Matsuoka K., Park K.A., Ito M., Ikeda K, Takeshita S. Osteoclast-derived complement component 3a stimulates osteoblast diff erentiation // J Bone Miner Res. – 2014. – V.29, №7. – P.1522-1530. https://doi.org/10.1002/jbmr.2187
21. Wang L., Liu S., Zhao Y., Liu D., Liu Y. et al. Osteoblastinduced osteoclast apoptosis by fas ligand/FAS pathway is required for maintenance of bone mass // Cell Death Differ. – 2015. – V.22, №10. – Р.1654-1664. https://doi.org/10.1038/cdd.2015.14
22. Delgado-Calle J., Sato A.Y., Bellido T. Role and mechanism of action of sclerostin in bone // Bone. – 2017. – V.96. – P.29-37. https://doi.org/10.1016/j.bone.2016.10.007
23. Ota K., Quint P., Ruan M., Pederson L., Westendorf J.J. et al. Sclerostin is expressed in osteoclasts from aged mice and reduces osteoclast-mediated stimulation of mineralization // J Cell Biochem. – 2013. – V.114, №8. – P.1901-1907. https://doi.org/10.1002/jcb.24537
24. Ignatius A., Schoengraf P., Kreja L., Liedert A., Recknagel S. et al. Complement C3a and C5a modulate osteoclast formation and inflammatory response of osteoblasts in synergism with IL-1β // J Cell Biochem. – 2011. – V.112, №9. – P.2594-2605. https://doi.org/10.1002/jcb.23186
25. Meshcheryakova A., Mechtcheriakova D., Pietschmann P. Sphingosine 1-phosphate signaling in bone remodeling: multifaceted roles and therapeutic potential // Expert Opin Ther Targets. – 2017. – V.21, №7. – P.725-737. https://doi.org/10.1080/14728222.2017.1332180
26. Kim B.J., Lee Y.S., Lee S.Y., Baek W.Y., Choi Y.J. et al. Osteoclast-secreted SLIT3 coordinates bone resorption and formation // J Clin Invest. – 2018. – V.128, №4. – P.1429-1441. https://doi.org/10.1172/JCI91086
27. Kim B.J., Koh J.M. Coupling factors involved in preserving bone balance // Cell Mol Life Sci. – 2019. – V.76, №7. – P.1243-1253. https://doi.org/10.1007/s00018-018-2981-y
28. Поворознюк В.В., Резниченко Н.А., Майлян Э.А. Роль иммунных факторов в патогенезе постменопаузального остеопороза // Проблемы остеологии. – 2013. – Т.16, №3. – С.3-7.
29. Weitzmann M.N., Pacifi ci R. Estrogen defi ciency and bone loss: an inflammatory tale // J. Clin. Invest. – 2006. – V.116, №5. – P.1186-1194. https://doi.org/10.1172/JCI28550
30. Ono T., Nakashima T. Recent advances in osteoclast biology // Histochem Cell Biol. – 2018. – V.149, №4. – P.325-341. https://doi.org/10.1007/s00418-018-1636-2
31. Ono T., Hayashi M., Sasaki F., Nakashima T. RANKL biology: bone metabolism, the immune system, and beyond // Infl amm Regen. – 2020. – V.40. – P.2. https://doi.org/10.1186/s41232-019-0111-3
32. Boyce B.F., Xiu Y., Li J., Xing L., Yao Z. NF-κB-Mediated Regulation of Osteoclastogenesis // Endocrinol Metab (Seoul). – 2015. – V.30, №1. – Р.35-44. https://doi.org/10.3803/EnM.2015.30.1.35
33. Phetfong J., Sanvoranart T., Nartprayut K., Nimsanor N., Seenprachawong K. et al. Osteoporosis: the current status of mesenchymal stem cell-based therapy // Cell Mol Biol Lett. – 2016. – V.21. – P.12. https://doi.org/10.1186/s11658-016-0013-1
34. Amarasekara D.S., Yun H., Kim S., Lee N., Kim H., Rho J. Regulation of Osteoclast Diff erentiation by Cytokine Networks // Immune Netw. – 2018. – V.18, №1. – Р.8. https://doi.org/10.4110/in.2018.18.e8
35. Weitzmann M.N. Bone and the Immune System // Toxicol Pathol. – 2017. – V.45, №7. – Р.911-924. https://doi.org/10.1177/0192623317735316
36. Okamoto K., Nakashima T., Shinohara M., Negishi-Koga T., Komatsu N. et al. Osteoimmunology: The Conceptual Framework Unifying the Immune and Skeletal Systems // Physiol Rev. – 2017. – V.97, №4. – Р.1295-1349. https://doi.org/10.1152/physrev.00036.2016
37. Tobeiha M., Moghadasian M.H., Amin N., Jafarnejad S. Pathway: A Mechanism Involved in Exercise-Induced Bone Remodeling // Biomed Res Int. – 2020. – V.2020. – Р.6910312. https://doi.org/10.1155/2020/6910312
38. Li Y., Toraldo G., Li A., Yang X., Zhang H. et al. B cells and T cells are critical for the preservation of bone homeostasis and attainment of peak bone mass in vivo // Blood. – 2007. – V.109, №9. – Р.3839-3848. https://doi.org/10.1182/blood-2006-07-037994
39. Jung S.M., Kim K.W., Yang C.W., Park S.H., Ju J.H. Cytokine-mediated bone destruction in rheumatoid arthritis // J Immunol Res. – 2014. – V.2014. – Р.263625. https://doi.org/10.1155/2014/263625
40. Brincat S.D., Borg M., Camilleri G., Calleja-Agius J. The role of cytokines in postmenopausal osteoporosis // Minerva Ginecol. – 2014. – V.66, №4. – Р.391-407.PMID: 25020058
41. Dar H.Y., Azam Z., Anupam R., Mondal R.K., Srivastava R.K. Osteoimmunology: The Nexus between bone and immune system // Front Biosci (Landmark Ed). – 2018. – V.23. – Р.464-492. https://doi.org/10.2741/4600
42. Kany S., Vollrath J.T., Relja B. Cytokines in inflammatory Disease // Int J Mol Sci. – 2019. – V.20, №23. – Р.6008. https://doi.org/10.3390/ijms20236008
43. De Martinis M., Sirufo M.M., Suppa M., Ginaldi L. IL-33/IL-31 Axis in Osteoporosis // Int J Mol Sci. – 2020. – V.21, №4. – Р.1239. https://doi.org/10.3390/ijms21041239
44. Park-Min K.H. Mechanisms involved in normal and pathological osteoclastogenesis // Cell Mol Life Sci. – 2018. – V.75, №14. – Р.2519-2528. https://doi.org/10.1007/s00018-018-2817-9
Об авторах
Г. А. ИгнатенкоУкраина
Игнатенко Григорий Анатольевич, д.м.н., профессор, заведующий кафедрой пропедевтической и внутренней медицины
Донецк, ДНР
И. Г. Немсадзе
Украина
Немсадзе Илона Гурамовна, ассистент кафедры акушерства и гинекологии
Донецк, ДНР
Е. Д. Мирович
Украина
Мирович Евгений Давидович, д.м.н., профессор кафедры акушерства и гинекологии
Донецк, ДНР
А. В. Чурилов
Украина
Чурилов Андрей Викторович, д.м.н., профессор, заведующий кафедрой акушерства и гинекологии
Донецк, ДНР
Э. А. Майлян
Украина
Майлян Эдуард Апетнакович, д.м.н., профессор кафедры клинической иммунологии, аллергологии и эндокринологии
Донецк, ДНР
А. Э. Глазков
Россия
Глазков Илья Сергеевич, д.м.н., главный врач
Симферополь
З. С. Румянцева
Россия
Румянцева Зоя Сергеевна, к.м.н., заведующая кафедрой акушерства, гинекологии и перинатологии №1
Симферополь
Рецензия
Для цитирования:
Игнатенко Г.А., Немсадзе И.Г., Мирович Е.Д., Чурилов А.В., Майлян Э.А., Глазков А.Э., Румянцева З.С. Роль цитокинов в ремоделировании костной ткани и патогенезе постменопаузального остеопороза. Медицинский вестник Юга России. 2020;11(2):6-18. https://doi.org/10.21886/2219-8075-2020-11-2-6-18
For citation:
Ignatenko G.A., Nemsadze I.G., Mirovich E.D., Churilov A.V., Maylyan E.A., Glazkov I.S., Rumyantceva Z.S. The role of cytokines in bone remodeling and the pathogenesis of postmenopausal osteoporosis. Medical Herald of the South of Russia. 2020;11(2):6-18. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-2-6-18







































