Перейти к:
Роль высокоэффективной жидкостной хроматографии в определении функционального состояния надпочечников до и после операции по поводу кортикостеромы
https://doi.org/10.21886/2219-8075-2020-11-2-30-37
Аннотация
Цель: оценить функциональное состояние коры надпочечников после хирургического лечения у больных с кортикостеромами для оптимизации тактики послеоперационного ведения.
Материалы и методы: обследовано 93 пациента (19 мужчин и 74 женщины) в возрасте 51,3 ± 10,1 года с объемным образованием надпочечника и 27 здоровых лиц (группа контроля) в возрасте 45,5 ± 5,7 лет. Односторонняя адреналэктомия проведена 22 больным СК и 20 пациентам из 43 с автономной секрецией кортизола. Всем больным проведен анализ клинической картины, объективных, лабораторных и инструментальных данных в дооперационном и раннем послеоперационном периодах. Оценка уровней глюкокортикоидных и минералокортикоидных гормонов в биологических жидкостях выполнялась методами иммуноанализа и высокоэффективной жидкостной хроматографии.
Результаты: признаки недостаточности коры надпочечников в раннем послеоперационном периоде получены у 77 % больных, прооперированных по поводу синдрома Кушинга, и у 25 % больных, прооперированных по поводу автономной секреции кортизола, по данным иммуноанализа и высокоэффективной жидкостной хроматографии. Повышение в дооперационном периоде уровня кортикостерона в сыворотке крови у всех больных, увеличение уровней 11-дезоксикортизола и 18-ОН-кортикостерона в сыворотке крови, экскреции с мочой свободного кортизона, 18-ОН-кортикостерона и 6β-гидроксикортизола у больных синдромом Кушинга указывают на возможность развития недостаточности надпочечников в раннем послеоперационном периоде.
Выводы: определение предшественников кортизола и альдостерона методом высокоэффективной жидкостной хроматографии увеличивает точность диагностики глюкокортикоидной и минералокортикоидной функций коры надпочечников у пациентов с синдромом Кушинга и с автономной секрецией кортизола в раннем послеоперационном периоде.
Ключевые слова
Для цитирования:
Буйнова М.О., Ворохобина Н.В., Великанова Л.И., Стрельникова Е.Г., Баранов В.Л. Роль высокоэффективной жидкостной хроматографии в определении функционального состояния надпочечников до и после операции по поводу кортикостеромы. Медицинский вестник Юга России. 2020;11(2):30-37. https://doi.org/10.21886/2219-8075-2020-11-2-30-37
For citation:
Buinova M.O., Vorokhobina N.V., Velikanova L.I., Strelnikova E.G., Baranov V.L. The role of high performance liquid chromatography in the functional state of the adrenal glands before and after surgical treatment for corticosteroma. Medical Herald of the South of Russia. 2020;11(2):30-37. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-2-30-37
Введение
Всех пациентов после удаления кортикостеромы по поводу синдрома Кушинга (СК) рекомендуется вести как больных с острой надпочечниковой недостаточностью, так как функция противоположного надпочечника может быть подавлена [1]. К сожалению, определение уровня кортизола в сыворотке крови и в слюне методом иммуноанализа не всегда достаточно для диагностики надпочечниковой недостаточности. В настоящее время используют стимуляционный тест с синтетическим аналогом кортикотропина (АКТГ) для оценки дефицита кортизола [2]. В Российской Федерации данный препарат не зарегистрирован. В связи с отсутствием высокочувствительных и высокоспецифичных методов диагностики надпочечниковой недостаточности представляется актуальным использование хроматографических методов.
В 1973 г. W.H. Beierwaltes и соавт. для обозначения лабораторно выявляемого гиперкортицизма без клинических проявлений предложили термин «субклинический синдром Кушинга» [3]. В 2016 г. Европейская ассоциация эндокринологов предложила заменить этот термин на «автономную секрецию кортизола» (АСК) [4]. У пациентов с АСК не развивается яркой картины СК, однако исследования показали, что для АСК характерны такие метаболические проявления гиперпродукции глюкокортикоидов, как ожирение, нарушение углеводного обмена, артериальная гипертензия, дислипидемия, остеопороз. Механизмы развития субклинической гиперпродукции глюкокортикоидов мало известны, в связи с чем методы консервативного лечения, как альтернативы оперативному лечению, не разработаны [5].
Согласно современным международным рекомендациям, абсолютными показаниями к проведению хирургического лечения АСК являются лучевые признаки злокачественности образования по данным компьютерной томографии (КТ) [4]. После оперативного лечения больных с АСК необходимо помнить о возможном развитии надпочечниковой недостаточности после хирургического лечения, в связи с чем рекомендуется проводить послеоперационное лечение глюкокортикоидами. Вероятность наличия надпочечниковой недостаточности в послеоперационном периоде у этих больных ниже, чем у больных с СК, поэтому особенно важно уточнение глюкокортикоидной и минералокортикоидной активности коры надпочечников для решения вопроса о необходимости заместительной терапии.
Материалы и методы
Обследовано 93 пациента (19 мужчин и 74 женщины) в возрасте 51,3 ± 10,1 года с объемным образованием надпочечника и 27 здоровых лиц (группа контроля) в возрасте 45,5 ± 5,7 лет. Всем пациентам проводили сбор анамнеза, объективный осмотр, лабораторное и инструментальное обследования. Методами иммунохемилюминесцентного (ИХЛА) и иммуноферментного анализа (ИФА) определяли уровни АКТГ в плазме крови, альдо- стерона (АЛД), ренина и кортизола в сыворотке крови, метанефрины и норметанефрины в плазме крови и моче, свободный кортизол в слюне (СКС). Проводили подавляющие дексаметазоновые тесты (ПДТ) с 1 мг, 2 мг и 8 мг. Методом высокоэффективной жидкостной хроматографии (ВЭЖХ) определяли уровни кортизола (F), кортизона (Е), кортикостерона (В), 11-дезоксикортизола (S), 11-де- зоксикортикостерона (DOC), 11-дегидрокортикостерона (А) и 18-ОН-кортикостерона (18-ОНВ) в сыворотке крови, экскрецию с мочой свободного кортизола (UFF), свободного кортизона (ОТЕ), 18-ОН-кортикостерона (U18- ОНВ) и 6β-гидроксикортизола (U6β-ОНF), рассчитывали соотношения F/E, В/А, UFF/ UFE и U6β-ОНF/ UFF
Согласно клиническим российским (2015 г.) и европейским рекомендациям (2016 г.), у 20 женщин и 2 мужчин в возрасте 48,1 ± 8,3 лет диагностирован СК, у 31 женщины и 12 мужчин в возрасте 53,7 ± 3,2 лет выявлена АСК по данным иммуноанализа. В каждой группе пациентов методом ВЭЖХ дополнительно определялись уровни предшественников и метаболитов кортикостероидов в крови и моче и оценивалась активность ферментов адреналового стероидогенеза.
Всем больным СК и 20 пациентам с АСК проведена односторонняя адреналэктомия. Показаниями к оперативному лечению пациентов с АСК были большой размер образования (43,0 ± 12,9 мм) или наличие признаков возможной злокачественности по данным лучевой диагностики (нативная плотность — 25,6 ± 17,3 HU, APW — 55,9 ± 18,9 %).
В первый день после операции всем больным СК и АСК забор крови проводили методом ИХЛА. Всем пациентам с СК с 1-го по 3-й дни после операции внутривенно вводили раствор преднизолона под контролем уровня кортизола в сыворотке крови, определенного методом ИХЛА. На 4-й день после операции пациентов, получающих преднизолон, переводили на таблетированные формы гидрокортизона. Всем прооперированным пациентам с СК и с АСК оценку функционального состояния коры надпочечника на 4-й день после операции (в раннем послеоперационном периоде) проводили методами ВЭЖХ и иммуноанализа. По результатам гормонального обследования, проведенного в раннем послеоперационном периоде (РПП), больных, прооперированных по поводу СК, разделили на две подгруппы: первую подгруппу (СК1) составили 17 пациентов с признаками недостаточности глюкокортикоидов (НГ), во вторую подгруппу (СК2) включили 5 больных без признаков НГ, по данным ИХЛА и ВЭЖХ. Средняя суточная доза преднизолона в первый день после операции у пациентов, прооперированных по поводу СК, с признаками НГ в раннем послеоперационном периоде составила 100 ± 36,7 мг/сут, а у пациентов, прооперированных по поводу СК, без признаков НГ в раннем послеоперационном периоде — 75 ± 38,7 мг/сут.
В РПП среди пациентов, прооперированных по поводу АСК, только у 5 больных были выявлены признаками НГ в РПП по данным ВЭЖХ. Заместительную гормональную терапию они не получали.
Статистическая обработка и визуализация полученных результатов осуществлялись с применением пакета программ для статистического анализа STAПSTIСA for WINDOWS (версия 10) и GraphPadPrism 6. При сравнении показателей дооперационного и послеоперационного периодов с показателями группы контроля использовался непараметрический U-критерий Манна-Уитни. Для сравнения показателей в динамике применялся тест Вилкоксона. При обработке данных проводился корреляционный анализ с использованием коэффициента ранговой корреляции Спирмена. Количественные показатели представлены в виде Me (LQ-UQ), где Me — медиана, LQ — нижний квартиль, UQ — верхний квартиль. Критерием статистической значимости считали величины р < 0,05. В ДОП для поиска оптимальных пороговых значений прогностических предикторов НГ в РПП использовали ROC анализ. Исследование проведено в соответствие с международными стандартами GCP.
Результаты
СК был диагностирован у больных с объемным образованием коры надпочечника на основании снижения уровня АКТГ (3,5 (3,0 - 7,5) пг/мл; 27,0 (16,0 - 39,0) пг/мл, р<0,0001) в плазме крови, повышения СКС (27,2 (18,6 - 34,9) нмоль/л; 6,6 (4,3 - 9,5) нмоль/л, p<0,0001), уровней кортизола в сыворотке крови в 9 ч., 21 ч. и отсутствия подавления кортизола после ПДТ с 2 мг (548 (450 - 680) нмоль/л; 38,0 (30,0 - 47,0) нмоль/л, p<0,0001) в сравнении с показателями ГК. Уровень кортизола после ПДТ с 8 мг у больных СК не отличался от его фонового уровня и составил 607 (378 - 660) нмоль/л, р=0,51.
АСК диагностирована у больных с объемным образованием коры надпочечника на основании снижения уровня АКТГ до 6,4 (4,0 - 9,6) пг/мл, p=0,0002, повышения СКС до 15,9 (13,7 - 28,7) нмоль/л, p<0,0001, увеличения уровня кортизола в 21 ч. и отсутствия подавления кортизола после ПДТ с 2 мг — 153 (109 - 218) нмоль/л, p=0,0007 в сыворотке крови в сравнении с показателями ГК.
По данным ВЭЖХ, у больных СК получено повышение уровней F, В, S в сыворотке крови и соотношений F/Е, В/А и UFF/ОТЕ (рис. 1). Полученные результаты указывают на повышение глюкокортикоидной функции коры надпочечников и снижение активности 11β - гидрокси- стероиддегидрогеназы 2 типа (11β-ГСДГ 2 типа).
У пациентов с АСК по данным ВЭЖХ получено увеличение уровня F и соотношения F/E в сыворотке крови (рис. 1). Экскреция с мочой UFF, UFE и U18-OHB была увеличена как у больных СК, так и у пациентов с АСК. Увеличение уровня 18-ОНВ в сыворотке крови у больных СК и его экскреции с мочой у пациентов с СК и с АСК указывают на увеличение минералокортикоидной функции коры надпочечников по данным ВЭЖХ.
В РПП больные, прооперированные по поводу СК, были разделены на две подгруппы в зависимости от уровня кортизола в 9 ч. по данным ИХЛА. Первую подгруппу (СК 1) составили 17 пациентов, прооперированных по поводу СК, у которых уровень кортизола в 9 ч. в сыворотке крови был меньше нижних референсных значений ГК (< 70 нмоль/л), во второй группе у 5 больных, прооперированных по поводу СК (СК 2), данный показатель находился в области референсных значений ГК (> 300 нмоль/л). У больных СК 1 получено снижение уровней кортизола в сравнении с показателями ГК, а у пациентов с СК 2 данные показатели не отличались от результатов ГК по данным ИХЛА и ВЭЖХ (рис. 2). В РПП у больных СК 1 были снижены уровни альдостерона и ренина в сравнении с показателями ГК, а у пациентов с СК 2 уровни альдостерона и ренина не отличались от результатов ГК (рис. 3). У больных СК 1 в РПП по данным ВЭЖХ получено снижение уровня В в сравнении с его уровнем в ДОП до 0,4 (0,4-0,5) нг/мл, р=0,018, а у пациентов с СК2 уровень В не отличался от его уровня в ДОП и составил 0,9 (0,7 - 1,1) нг/мл, р=0,07.
Результаты ВЭЖХ у больных СК 1 и СК 2 в ДОП были сравнены с показателями ГК. Уровень F в сыворотке крови у пациентов с СК 1 (141 (125 - 152) нг/мл; 75,1 (66,3 - 88,9) нг/мл, р<0,0001) и СК 2 (148 (88-179) нг/мл, р=0,01) был увеличен. У больных СК 1 в ДОП были дополнительно повышены уровни B, S, 18-OHB и соотношение В/А в сыворотке крови, а также экскреция с мочой U6β-ОНF в сравнении с показателями ГК (рис. 4 А, Б, С). Уровень S (р=0,04) в сыворотке крови был выше у больных СК 1 в сравнении с показателями СК 2 в ДОП. Экскреция с мочой UFF, UFE, U18-OHB, соотношения F/E и UFF/UFE были увеличены у больных СК 1 и СК 2 (рис. 4 Б, С). Таким образом, признаки снижения активности 11β-ГСДГ 2 типа получены у пациентов СК 1 и СК 2 (рис. 4 С).
Кроме этого, у пациентов, прооперированных по поводу СК, установлены отрицательные корреляционные связи уровня F в сыворотке крови в РПП с уровнем S (R = -0,81) в сыворотке крови и экскрецией с мочой Ш8-ОНВ (R= -0,88) в ДОП, а также уровня кортизола, определенного методом ИХЛА, с уровнем В (R= -0,56) и экскрецией с мочой UFE (R= -0,62), U6β-ОНF (R= -0,82) в ДОП. Уровни гормональных показателей в крови и моче в ДОП, по данным ВЭЖХ (В более 3,2 нг/ мл, 18-ОНВ более 3,7 нг/мл, S более 1,3 нг/мл, U18-OHB более 110 мкг/24 ч, 6β-OHF более 300 мкг/24 ч, UFE более 250 мкг/24 ч), с чувствительностью и специфичностью более 80 % предсказывали глюкокортикоидную недостаточность у больных, прооперированных по поводу СК.
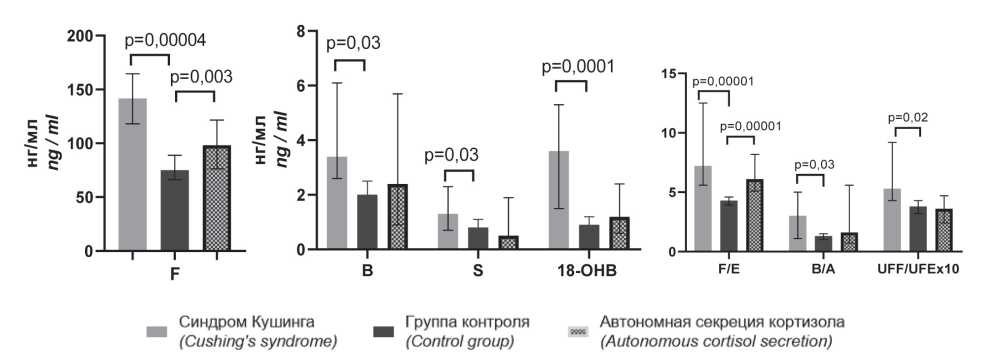
Рисунок 1. Глюкокортикоидная и минералокортикоидная функции коры надпочечников у пациентов с синдромом Кушинга и с автономной секрецией кортизола по данным ВЭЖХ в дооперационном периоде.
Figure 1. Glucocorticoid and mineralocorticoid functions of the adrenal cortex in patients with Cushing’s syndrome and patients with autonomous cortisol secretion according to the data of HPLC in the preoperative period.
Примечание: F — кортизол, E — кортизон, B — кортикостерон, A — 11-дегидрокортикостерон, S —11-дезоксикортизол, 18-ОНВ — 18-гидроксикортикостерон, UFF — свободный кортизол мочи, UFE — свободный кортизон мочи.
Notes: F — cortisol, E — cortisone, B — corticosterone, A — 11-dehydrocorticosterone, S — 11-deoxycortisol, 18-OHB —18-hydroxycorticosterone, UFF — free urine cortisol, UFE — free urine cortisone.

Рисунок 2. Уровни кортизола в 9 часов в сыворотке крови у больных синдромом Кушинга (СК 1 и СК 2)*, по данным ИХЛА и ВЭЖХ в раннем послеоперационном периоде (РПП).
Figure 2. Levels of cortisol at 9 am in patients with Cushing’s syndrome (CS 1 and CS 2)* according to immunoassayand HPLC in the early postoperative period.

Рисунок 3. Уровни альдостерона и ренина в сыворотке крови у больных СК 1 и СК 2* в сравнении с показателями группы контроля в раннем послеоперационном периоде.
Figure 3. Levels of aldosterone and renin in patients with CS 1 and CS 2* compared with the control group in the early postoperative period.
В РПП у больных, прооперированных по поводу АСК, уровни глюкокортикоидных гормонов в сыворотке крови (F, E, B, S, A) не отличались от показателей ГК (p>0,05).
Получено увеличение уровня 18-ОНВ в сыворотке крови и его экскреция с мочой, что указывает на повышение минералокортикоидной функции коры надпочечников (рис. 5).
По данным гистологического исследования, у всех пациентов, прооперированных по поводу АСК, выявлена адренокортикальная аденома. У 5 пациентов, прооперированных по поводу АСК со злокачественным потенциалом 1-3 балла по шкале L.M.Weiss, в РПП, по данным ВЭЖХ, были снижены уровни F, E и S, что свидетельствует об уменьшении глюкокортикоидной функции коры надпочечников (рис. 6). В ДОП у данных больных были повышены уровень В (9,9 (8,3 - 19,5) нг/мл; 4,3 (3,9 - 4,6) нг/мл, р=0,03) в сыворотке крови и соотношение B/A (8,5 (4,9 - 9,2); 1,3 (1,0 - 1,5), p=0,02) в сравнении с соответствующими показателями ГК и результатами РПП (р=0,02). Уровень В более 8,0 нг/мл в сыворотке крови, по данным ВЭЖХ, в ДОП с чувствительностью 100 % и специфичностью 92,3 % (АиС=0,92) предсказывал развитие глюкокортикоидной недостаточности в РПП у больных, прооперированных по поводу АСК.
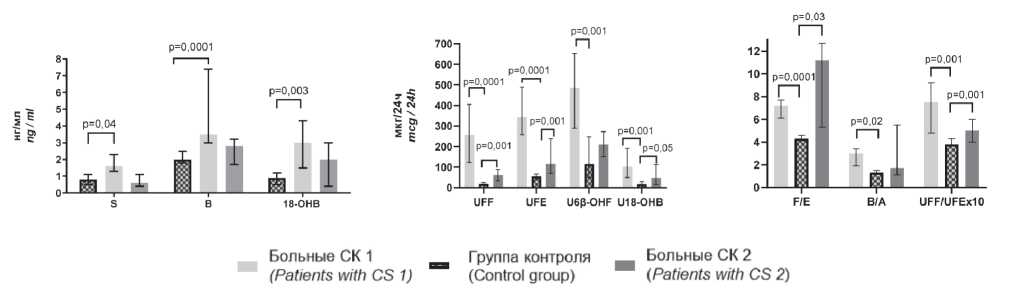
Рисунок 4. Глюкокортикоидная и минералокортикоидная функции коры надпочечников у больных СК 1 и СК 2* по данным ВЭЖХ в дооперационном периоде:
А) уровни S (11-дезоксикортизола), В (кортикостерона) и 18-ОНВ (18-гидроксикортикостерона) в сыворотке крови; Б) экскреция с мочой свободного кортизола (UFF), свободного кортизона (UFE), U6β-OHF (6β-гидроксикортизола) и U18-OHB (18-гидроксикортикостерона); C) признаки снижения активности 11β-гидроксистероиддегидрогеназы 2 типа.
Figure 4. Glucocorticoid and mineralocorticoid functions of the adrenal cortex in patients with CS 1 and CS 2* according to the data of HPLC in the preoperative period:
A) levels of S (11-deoxycortisol), B (corticosterone) and 18-OHB (18-hydroxycorticosterone) in serum of blood; B) urinary excretion of free cortisol (UFF), free cortisone (UFE), U6β-OHF (6β-hydroxycortisol) and U18-OHB (18-hydroxycorticosterone); C) signs of a decrease in the activity of 11β-hydroxysteroiddehydrogenase type 2.
Примечание: СК1 — больные СК с уровнем кортизола в 9 ч в сыворотке крови в РПП меньше нижних референсных значений ГК; СК2 — больные СК с уровнем кортизола в 9 ч в сыворотке крови в РПП в области референсных значений ГК.
Notes: CS 1 — patients with Cushing’s syndrome with a level of cortisol at 9 am less than the lower reference values of the control group in the early postoperative period; CS 2 — patients with Cushing’s syndrome with a level of cortisol at 9 am in the region of reference values of the control group in the early postoperative period.

Рисунок 5. Уровень 18-ОН-кортикостерона (18-ОНВ) в сыворотке крови и его экскреция с мочой (U18-OHB) в раннем послеоперационном периоде у больных, прооперированных по поводу автономной секрецией кортизола,по данным ВЭЖХ.
Figure 5. The level of blood 18-OH-corticosterone (18-OHB) and its urinary excretion (U18-OHB) in patients with autonomous cortisol secretion according to HPLC in the early postoperative period.

Рисунок 6. Уровни глюкокортикоидов в сыворотке крови у 5 пациентов, прооперированных по поводу автономной секрецией кортизола (АСК) со злокачественным потенциалом, в раннем послеоперационном периоде по данным ВЭЖХ.
Figure 6. Levels of glucocorticoids in blood serum in 5 patients with autonomous cortisol secretion (ACS) with malignant potential according to the data of HPLC in the early postoperative period.
Примечание: F — кортизол, E — кортизон, S — 11-дезоксикортизол.
Notes: F — cortisol, F — cortison, S — 11-deoxycortisol.
Обсуждение
Согласно европейским рекомендациям ENSAT, всех пациентов с синдромом Кушинга после удаления опухоли надпочечника необходимо вести как больных с острой надпочечниковой недостаточностью, так как функция противоположного надпочечника может быть подавлена [4]. Однако результаты настоящего исследования демонстрируют отсутствие недостаточности выработки глюкокортикоидов у ряда пациентов, прооперированных по поводу синдрома Кушинга. В исследовании у 23 % пациентов, прооперированных по поводу синдрома Кушинга, не установлены признаки недостаточности глюкокортикоидов в раннем послеоперационном периоде, то есть не все пациенты, прооперированные по поводу синдрома Кушинга, нуждаются в заместительной гормональной терапии. В дооперационном периоде у пациентов с синдромом Кушинга без признаков глюкокортикоидной недостаточности в раннем послеоперационном периоде среднее значение артериального давления было ниже, чем у пациентов с синдромом Кушинга с глюкокортикоидной недостаточностью. По результатам гистологического исследования ткани удаленного надпочечника у всех пациентов с синдромом Кушинга была кортикальная аденома (0-2 балла по шкале L.M.Weiss). У пациентов с автономной секрецией кортизола, согласно европейским рекомендациям ENSAT, необходимо помнить о возможном развитии надпочечниковой недостаточности после хирургического лечения, в связи с чем рекомендуется проводить послеоперационное лечение глюкокортикоидами у всех пациентов с опухолями надпочечников, где имеются доказательства автономной секреции кортизола, основным признаком которого является уровень кортизола >138 нмоль/л после ночного теста с 1 мг дек- саметазона [4]. Были проанализированы результаты обследования больных, прооперированных по поводу автономной секреции кортизола в раннем послеоперационном периоде, и получены признаки надпочечниковой недостаточности (латентное течение) только у 5 пациентов. У больных синдромом Кушинга недостаточность глюкокортикоидов была подтверждена данными иммуноанализа и данными высокоэффективной жидкостной хроматографии, а у пациентов с автономной секрецией кортизола — только данными высокоэффективной жидкостной хроматографии. Таким образом, определение глюкокортикоидов и минералокортикоидов методом высокоэффективной жидкостной хроматографии, является актуальным для диагностики латентной надпочечниковой недостаточности. У больных синдромом Кушинга с низким уровнем кортизола в раннем послеоперационном периоде были повышены уровни в крови кортикостерона, 18-ОН-кортикостерона, 11-дезокси- кортизола в дооперационном периоде. Кроме этого, у данных пациентов были выявлены признаки снижения активности 11р-гидроксистероиддегидрогеназы 2-го типа и уменьшение активности фермента CYP3A4, что свидетельствует о нарушении инактивации кортизола в крови и моче. Увеличение данных предшественников глюкокортикоидов и минералокортикоидов можно использовать в качестве прогностических маркеров надпочечниковой недостаточности в раннем послеоперационном периоде у больных с синдромом Кушинга. У 5 пациентов с автономной секрецией кортизола с недостаточностью глюкокортикоидов в раннем послеоперационном периоде прогностическим маркером оказался высокий уровень кортикостерона в дооперационном периоде.
Выводы
- В дооперационном периоде у пациентов с синдромом Кушинга и с автономной секрецией кортизола с признаками недостаточности глюкокортикоидов в раннем послеоперационном периоде были повышены уровень кортикостерона и соотношение кортикостерона к 11-дегидрокортикостерону, у пациентов с синдромом Кушинга дополнительно были увеличены уровни 18-ОН-кортикостерона, 11-дезоксикортизола в сыворотке крови и экскреция с мочой 6β-гидроксикортизола в отличие от пациентов с синдромом Кушинга и с автономной секрецией кортизола без признаков недостаточности глюкокортикоидов в раннем послеоперационном периоде.
- По данным высокоэффективной жидкостной хроматографии выявлены пороговые значения уровней кортикостерона (3,2 нг/мл), 11-дезоксикорти- зола (1,3 нг/мл), 18-ОН-кортикостерона (3,7 нг/мл) в сыворотке крови и экскреции с мочой свободного кортизона (250 мкг/24 ч), 18-ОН-кортикостерона (110 мкг/24 ч) и 6β-гидроксикортизола (300 мкг/24 ч) у больных синдромом Кушинга, при превышении которых в дооперационном периоде имеется риск развития недостаточности коры надпочечников в раннем послеоперационном периоде, что подтверждается наличием отрицательной корреляции с уровнем кортизола после операции.
- Для пациентов с автономной секрецией кортизола и злокачественным потенциалом 1-3 балла по шкале L.M. Weissуровень кортикостерона в сыворотке крови больше 8,0 нг/мл в дооперационном периоде с чувствительностью 92 % и специфичностью 100 % указывает на возможность развития недостаточности коры надпочечников в раннем послеоперационном периоде.
Финансирование. Исследование не имело спонсорской поддержки.
Finansing. The study did not have sponsorship.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. Authors declares no conflict of interest.
Список литературы
1. Ветшев П.С., Коваленко Е. И., Ветшев С. П. Инциденталома надпочечника: спорные вопросы диагностики и хирургической тактики // Хирургия им. Н.И. Пирогова. – 2004. - №6. – С. 62-65.
2. Raff H., Sharma S.T., Nieman L.K. Physiological Basis for the Etiology, Diagnosis, and Treatment of Adrenal Disorders: Cushing’s Syndrome, Adrenal Insuffi ciency, and Congenital Adrenal Hyperplasia // Compr Physiol. - 2014 - № 4(2) - Р. 739–769. https://doi.org/10.1002/cphy.c130035.
3. Beierwaltes W.H, Sturman M.F, Ryo U., Ice R.D. Imaging functional nodules of the adrenal glands with 131-I-19-iodocholesterol. // J Nucl Med. – 1974 - №15 – P. 246-251. PMID: 4361925
4. Fassnacht M., Arlt W., Bancos I., Dralle H., Newell-Price J., et al. Management of adrenal incidentalomas: European Society of Endocrinology Clinical Practice Guideline in collaboration with the European Network for the Srudy of Adrenal Tumors. // European Journal of Endocrinology – 2016 - №175. – Р. G1-G34. https://doi.org/10.1530/EJE-16-0467.
5. Кузнецов Н.С., Латкина Н.В., Каминарская Ю.А. Актуальность и перспективные направления изучение проблемы субклинического синдрома Кушинга // Эндокринная хирургия – 2016. – Т.10 - №1 – P. 13-22. https://doi.org/10.14341/serg2016113-22
Об авторах
М. О. БуйноваРоссия
Буйнова Мария Олеговна, аспирант кафедры эндокринологии им. ак. В.Г. Баранова
Санкт-Петербург
Н. В. Ворохобина
Россия
Ворохобина Наталья Владимировна, д.м.н. проф., заведующий кафедрой эндокринологии им. ак. В.Г. Баранова
Санкт-Петербург
Л. И. Великанова
Россия
Великанова Людмила Иосифовна, д.б.н., проф., заведующий НИЛ хроматографии
Санкт-Петербург
Е. Г. Стрельникова
Россия
Стрельникова Елена Геннадьевна, к.х.н. ст.н.с. НИЛ хроматографии
Санкт-Петербург
В Л Баранов
Россия
Баранов Виталий Леонидович, д.м.н. профессор кафедры эндокринологии им. ак. В.Г. Баранова
Санкт-Петербург
Рецензия
Для цитирования:
Буйнова М.О., Ворохобина Н.В., Великанова Л.И., Стрельникова Е.Г., Баранов В.Л. Роль высокоэффективной жидкостной хроматографии в определении функционального состояния надпочечников до и после операции по поводу кортикостеромы. Медицинский вестник Юга России. 2020;11(2):30-37. https://doi.org/10.21886/2219-8075-2020-11-2-30-37
For citation:
Buinova M.O., Vorokhobina N.V., Velikanova L.I., Strelnikova E.G., Baranov V.L. The role of high performance liquid chromatography in the functional state of the adrenal glands before and after surgical treatment for corticosteroma. Medical Herald of the South of Russia. 2020;11(2):30-37. (In Russ.) https://doi.org/10.21886/2219-8075-2020-11-2-30-37







































